摘要:23.酸.碱.盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动. ⑴同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖.立即就能把它们区分开来.这是为什么? (2)右图是某试剂瓶标签上的内容.要把10 g这种浓硫酸稀释为20%的硫酸.需要水的质量为 g.稀释浓硫酸时.不可将水倒进浓硫酸里.请解释其原因. (3)为探究一瓶氢氧化钠固体的变质情况.同学们进行了如下实验. ①取少量该固体样品置于试管中.向其中加入一种无色溶液.发现有气泡产生.说明该样品中含有碳酸钠.由此可确定该固体已发生变质.则无色溶液可能是 . ②为探究该固体中是否还有未变质的氢氧化钠.同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性.它的存在会对氢氧化钠的检验造成干扰.请根据右图部分物质的溶解性表所提供的信息.将下表填写完整. 实验目的 实验操作 现象 结论或化学方程式 除去碳酸钠 取少量该固体样品溶于水配成溶液.滴加适量的 溶液. 充分反应后过滤 有白色沉淀生成 有关反应的化学方程式为 检验是否含有氢氧化钠 在滤液中滴加酚酞溶液 该样品中含有氢氧化钠 (4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和.试计算反应后所得溶液中溶质的质量分数. 思路方法点拨:本题是一道围绕酸.碱.盐知识的综合应用题.试题的开放性很强.是对考生的科学探究能力.计算能力.分析问题的能力.过程与方法等的综合考查.第⑴小题是对科学探究的过程与方法的考查.打开盛浓盐酸和浓硫酸试剂瓶的瓶盖.立即就能把它们区分开来.是由于探究过程中可以看到瓶口有的有白雾.有的没有.原因是浓盐酸具有挥发性.挥发出氯化氢气体在瓶口与空气中的水蒸气形成盐酸小液滴的缘故.第(2)小题类似下册课本第43页例题2.考查溶液稀释方法和有关计算.根据溶液稀释前后溶质质量不变.(试剂瓶标签上信息知浓硫酸的质量分数为98%)设需要加入水的质量为X:10g×98%=×20% 解之.X=39g .稀释浓硫酸时.由于水的密度较小.浮在浓硫酸上面.而且浓硫酸溶解时放出的热会使水立刻沸腾.使硫酸液滴向四周飞溅.所以不可将水倒进浓硫酸里.第(3)小题①考查碱的化学性质和分析推理能力.NaOH变质是NaOH和空气中的CO2作用.生成了Na2CO3和H2O.检验NaOH是否变质实际上是检验NaOH中是否含有Na2CO3.酸可以选用HCl.H2SO4等,第(3)小题②要想探究该固体中是否还有未变质的氢氧化钠.根据下表实验步骤.必须先除去碳酸钠.再检验是否还有未变质的氢氧化钠.因此.题目综合分析难度稍高.隐藏了先除杂后检验信息.除去碳酸钠.即把碳酸根转化成气体或沉淀.根据本题情况.若加入酸.把碳酸根转化成气体.会影响下一步对氢氧化钠的检验.所以只能设法把碳酸根转化成沉淀.根据物质的溶解性表信息知.可以加入氢氧化钡或可溶性钡盐.但加入氢氧化钡影响下一步对氢氧化钠的检验.因此只可加入硝酸钡或氯化钡溶液.(注:此题物质的溶解性表中没有钙离子.实际上可溶性钙盐也可以)第(4)小题是对根据化学方程式进行计算和溶液的质量分数的综合能力的考查.
网址:http://m.1010jiajiao.com/timu_id_3970335[举报]
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.(1)盐酸、硫酸等具有相似的化学性质,是因为二者的水溶液中都含有
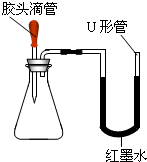
(2)如图是甲同学设计的趣味实验装置,其气密性良好.若胶头滴管中的物质是浓NaOH溶液,锥形瓶中充满CO2,则挤压胶头滴管后能观察到什么现象?并写出有关反应的化学方程式.
(3)盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.乙同学和丙同学对这种白色粉末的成分进行了如下猜想和验证.
(Ⅰ)可能是NaOH(Ⅱ)可能是Na2CO3(Ⅲ)可能是NaOH与Na2CO3的混合物
①乙同学向所取少量粉末中滴加一种溶液后,排除了(Ⅰ)的可能性.请你推测他所加的试剂和观察到的现象.
②丙同学提议用酚酞试液来鉴定,你认为可行吗?请简要说明理由.
(4)某同学对附近一家化工厂排放的污水中的氢氧化钠含量进行了测定.他取了40g污水于烧杯中,逐滴加入5%的稀盐酸中和,当恰好完全反应时,用去稀盐酸7.3g.请计算废水中氢氧化钠的质量分数. 查看习题详情和答案>>
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)熟石灰是一种重要的碱,在工农生产和日常生活中都有十分广泛的应用.工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰.请你写出有关反应的化学方程式.
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
(5)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
查看习题详情和答案>>
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是________.
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验..请将下表填写完整.
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的________溶液,充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 ________ |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入几滴酚酞试液 | ________ | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为______g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是______.
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的______溶液, 充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 ______ |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | ______ | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是因为______.
(2)右图是某试剂瓶标签上的内容.要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为______g.稀释浓硫酸时,正确的操作:将______沿着烧杯内壁慢慢注入______,同时用玻璃棒不断搅拌.
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |