网址:http://m.1010jiajiao.com/timu_id_3968170[举报]
Ⅱ、如图所示,C、D为多孔惰性电极.
(1)当开关K闭合后,C、D电极周围都会出现的现象是______;
(2)再从M处注入几滴石蕊试液,溶液变红.试分析:
①电源A端为______(填“正”或“负”)极;
②D处的电极反应式为______.
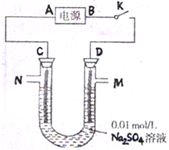
Ⅱ、如图所示,C、D为多孔惰性电极.
(1)当开关K闭合后,C、D电极周围都会出现的现象是______;
(2)再从M处注入几滴石蕊试液,溶液变红.试分析:
①电源A端为______(填“正”或“负”)极;
②D处的电极反应式为______.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)氮化铝是一种性能良好的高温结构陶瓷,它的电子式:_________; 铁在周期表中的位置:_____________;
(2)铜生成铜绿是生活中常见的现象,其反应原理用方程式表示:_________; 氢氧化铝被称为两性氢氧化物,写出其酸式电离方程式:__________________;
(3)高铁酸盐被科学家们公认为绿色消毒剂, 它可以通过如下途径制备:次氯酸盐氧化法制备:采用次氯酸盐氧化法,在10.00 mL质量分数为8%的次氯酸钠溶液中加入5.5 g氢氧化钠和0.70 g硫酸铁,可制备摩尔浓度(物质的量浓度)为0.01 mol/L的高铁酸钠,写出制备的离子方程式: __________________高铁酸钠不仅可以消毒,也可以作净水剂,陈述理由:__________________
(4)燃料电池如图所示,写出石墨(I)电极上发生的电极反式:__________________ 。以此燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为_____________.。




(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________.
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) ΔH<0
C.2H2(g)+O2(g)=2H2O(1) ΔH<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为________.
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为CuSO4溶液则阳极的电极反应式为________,电解时的化学反应方程式为________,通过一段时间后,向所得溶液中加入0.2 mol CuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为________.
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为________
③若用此装置电解精炼铜,________做阳极,电解液CuSO4的浓度________(填“增大”、“减小”或“不变”).
④若用此装置在铁制品上镀铜,铁制品做________,电镀液的浓度________(填“增大”、“减小”或“不变”).
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在可以设计成原电池的是________.
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) ΔH<0
C.2H2(g)+O2(g)=2H2O(1) ΔH<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为________.
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为CuSO4溶液,则阳极的电极反应式为________,电解时的化学反应方程式为________,通过一段时间后,向所得溶液中加入0.2 mol CuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为________.
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为________
③若用此装置电解精炼铜,________做阳极,电解液CuSO4的浓度________(填“增大”、“减小”或“不变”).
④若用此装置在铁制品上镀铜,铁制品做________,电镀液的浓度________(填“增大”、“减小”或“不变”).