题目内容
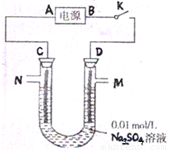
Ⅰ、铁单质及其化合物在生活生产中应用广泛.如硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)______.在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降除去,其原因是______.Ⅱ、如图所示,C、D为多孔惰性电极.
(1)当开关K闭合后,C、D电极周围都会出现的现象是______;
(2)再从M处注入几滴石蕊试液,溶液变红.试分析:
①电源A端为______(填“正”或“负”)极;
②D处的电极反应式为______.
【答案】分析:Ⅰ、根据题意写出反应三价铁水解的离子方程式并分析不能使酸性废水中的悬浮物沉降除去的原因;
Ⅱ、在电解池中,氢离子得电子的电极附近碱性增强,和电源的正极相连的是阳极,和电源的负极相连的是阴极,根据电解池的工作原理来回答.
解答:解:Ⅰ、氯化铁为强酸弱碱盐,在水中发生水解Fe3++3H2O Fe(OH)3+3H+,生成氢氧化铁胶体,可起到净水作用,在酸性条件下,抑制了酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,不能使酸性废水中的悬浮物沉降除去,
Fe(OH)3+3H+,生成氢氧化铁胶体,可起到净水作用,在酸性条件下,抑制了酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,不能使酸性废水中的悬浮物沉降除去,
故答案为:Fe3++3H2O Fe(OH)3+3H+;在酸性条件下,抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去;
Fe(OH)3+3H+;在酸性条件下,抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去;
Ⅱ、(1)当开关K闭合后,形成电解池,电解硫酸钠的实质是相当于电解水,两极上分别产生氢气和氧气,所以C、D电极周围都会出现的现象是有气泡产生,
故答案为:有气泡产生;
(2)①再从M处注入几滴石蕊试液,溶液变红,说明D电极上是氢氧根放电,该极为阳极,N为阴极,所以A 是电源的负极,故答案为:负;
②D电极上是氢氧根放电,该极为阳极,D处的电极反应式为:4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O.
点评:本题考查学生盐的水解以及电化学知识,可以根据所学内容来回答,难度不大.
Ⅱ、在电解池中,氢离子得电子的电极附近碱性增强,和电源的正极相连的是阳极,和电源的负极相连的是阴极,根据电解池的工作原理来回答.
解答:解:Ⅰ、氯化铁为强酸弱碱盐,在水中发生水解Fe3++3H2O
 Fe(OH)3+3H+,生成氢氧化铁胶体,可起到净水作用,在酸性条件下,抑制了酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,不能使酸性废水中的悬浮物沉降除去,
Fe(OH)3+3H+,生成氢氧化铁胶体,可起到净水作用,在酸性条件下,抑制了酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,不能使酸性废水中的悬浮物沉降除去,故答案为:Fe3++3H2O
 Fe(OH)3+3H+;在酸性条件下,抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去;
Fe(OH)3+3H+;在酸性条件下,抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去;Ⅱ、(1)当开关K闭合后,形成电解池,电解硫酸钠的实质是相当于电解水,两极上分别产生氢气和氧气,所以C、D电极周围都会出现的现象是有气泡产生,
故答案为:有气泡产生;
(2)①再从M处注入几滴石蕊试液,溶液变红,说明D电极上是氢氧根放电,该极为阳极,N为阴极,所以A 是电源的负极,故答案为:负;
②D电极上是氢氧根放电,该极为阳极,D处的电极反应式为:4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O.
点评:本题考查学生盐的水解以及电化学知识,可以根据所学内容来回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,3 mol
FeS2参加反应转移________mol
电子。
6SO2+Fe3O4,3 mol
FeS2参加反应转移________mol
电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
________________________________________________________________________。
从腐蚀废液回收得到金属铜还需要的试剂为
________________________________________________________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是____________________________________________________ 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
Ⅰ 对;Ⅱ对;无 |
|
C |
铁属于过渡元素 |
铁和铁的某些化合物可以用作催化剂 |
Ⅰ 错;Ⅱ对;无 |
|
D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
Ⅰ 对;Ⅱ对;有 |
 (2011?万州区一模)Ⅰ、铁单质及其化合物在生活生产中应用广泛.如硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)
(2011?万州区一模)Ⅰ、铁单质及其化合物在生活生产中应用广泛.如硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示) Fe(OH)3+3H+
Fe(OH)3+3H+