题目内容
硫酸亚铁铵〔(NH4)2Fe(SO4)2·6H2O〕又称莫尔盐,它是浅绿色晶体,比一般亚铁盐稳定,是常用的分析试剂。莫尔盐在水中的溶解度小于硫酸铵、硫酸亚铁。制备莫尔盐的化学方程式为:(NH4)2SO4+FeSO4+6H2O![]() (NH4)2Fe(SO4)2·6H2O。
(NH4)2Fe(SO4)2·6H2O。
某研究性学习小组设计的在实验室用废铁屑制备莫尔盐的步骤如下:
①将废铁屑放入10%的Na2CO3溶液中煮沸除油污,冷却,洗涤,倾析得铁屑;
②将处理过的铁屑放入过量的3 mol·L-1 H2SO4溶液中,控温在50 —
③将一定量硫酸铵加入到硫酸亚铁溶液中,使其完全溶解;
④从溶液中分离出莫尔盐晶体。
试回答:
(1)步骤②中存在设计缺陷,应改进为_________________,改进的目的是(用离子方程式表示)_________________。
(2)步骤④从溶液中分离出莫尔盐晶体的实验操作包括________________________。
(3)请设计实验,检验莫尔盐晶体中是否含有Fe3+。__________________________。
(1)第②步应加入过量的铁屑 Fe+2Fe3+![]() 3Fe2+
3Fe2+
(2)加热浓缩,降温结晶,过滤
(3)取少量晶体于试管中,加适量水溶解,再滴入几滴KSCN溶液,若溶液变为红色,证明存在Fe3+,若溶液不变红色,证明不存在Fe3+
解析:因铁屑表面有氧化物,故应加入过量的铁屑以保证Fe3+转化为Fe2+,2Fe3++Fe![]() 3Fe2+;
3Fe2+;
因莫尔盐的溶解度较小,可采用:加热浓缩、降温结晶、过滤操作;
Fe3+的特性之一是与KSCN显血红色,取少量莫尔盐晶体,制成溶液,滴入几滴KSCN溶液,若溶液变为血红色则含Fe3+,否则不含Fe3+

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
图Ⅰ
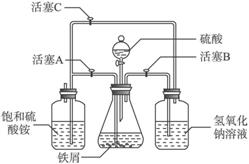
图Ⅱ
请回答下列问题:
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是___________,集气瓶的作用是______________;烧杯中主要发生:①CuSO4+H2S![]() CuS↓+H2SO4
CuS↓+H2SO4
②4CuSO4+PH3+4H2O![]() H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
(2)图Ⅱ用于制备硫酸亚铁铵。在0—
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,可制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级—Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制_________过量为最佳。

