摘要:(1)10.0g (2)高于,将左边的平衡螺母左旋移动或将右边的平衡螺母左旋.直至天平平衡,32.6g ↓↑,↓,↓↑,↓,↓↑, ACD
网址:http://m.1010jiajiao.com/timu_id_3964739[举报]
现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生取20.0 g样品置于烧杯中,分四次加入密度为1.22 g·cm-3的硫酸并做相关记录.有关数据记录如下:
|
加硫酸的序号 |
加入硫酸的体积/mL |
剩余固体的质量/g |
|
1 |
20.0 |
16.0 |
|
2 |
20.0 |
12.0 |
|
3 |
20.0 |
8.0 |
|
4 |
20.0 |
8.0 |
试计算:
(1)10.0g样品中铜的质量;
(2)样品中氧化亚铁的质量分数;
(3)所用硫酸溶液溶质的质量分数.
查看习题详情和答案>>
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10).试回答:
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积Ksp= .
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用 指示剂,理由是 ;
判断到达滴定终点的实验现象是 .
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol?L-1的盐酸标准液进行滴定,相关数据记录如表
①实验3到达滴定终点时所耗HCl溶液的体积为 ;依据表中数据,计算出烧碱样品中含NaOH的质量分数为 %.(小数点后保留两位数字)
②滴定时的正确操作是 .
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数.
查看习题详情和答案>>
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积Ksp=
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用
判断到达滴定终点的实验现象是
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol?L-1的盐酸标准液进行滴定,相关数据记录如表
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
②滴定时的正确操作是
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数.
摩尔盐[xFeSO4?y(NH4)2SO4?zH2O]是一种重要化工原料.其组成可通过下列实验测定:
①称取1.568 0g样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.466 0g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL.
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(S
)≤1.0×10-5 mol?L-1,应保持溶液中c(Ba2+ )≥
(2)③中发生反应的离子方程式为
(3)通过计算确定样品的组成(必须写出计算过程).
查看习题详情和答案>>
①称取1.568 0g样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.466 0g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL.
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(S
| O | 2- 4 |
1.1×10-5
1.1×10-5
mol?L-1.(2)③中发生反应的离子方程式为
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
,滴定终点的现象是滴入最后一滴KMnO4时,溶液由无色变为浅紫色,且半分钟内不变色
滴入最后一滴KMnO4时,溶液由无色变为浅紫色,且半分钟内不变色
.(3)通过计算确定样品的组成(必须写出计算过程).
如图是两个实验装置(铁架台等辅助仪器略去未画)
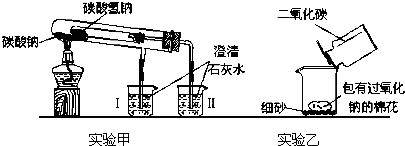
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧.写出Na2O2与CO2反应的化学方程式
(3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g.求(要求写出计算过程):
①生成的CO2气体体积(标准状况下)
②原混合物中碳酸钠的质量分数.
查看习题详情和答案>>

回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是
Ⅱ
Ⅱ
(填“Ⅰ”、“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是:Ca2++2OH-+CO2=CaCO3↓+H2O
Ca2++2OH-+CO2=CaCO3↓+H2O
,通过实验甲可比较出Na2CO3、NaHCO3两种固体,Na2CO3
Na2CO3
更稳定.(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧.写出Na2O2与CO2反应的化学方程式
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
,棉花能着火燃烧说明该反应特点是该反应能放出大量的热
该反应能放出大量的热
.(3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g.求(要求写出计算过程):
①生成的CO2气体体积(标准状况下)
②原混合物中碳酸钠的质量分数.