摘要: 验满:(1)湿润的红色石蕊试纸 (2)蘸浓盐酸的玻璃棒
网址:http://m.1010jiajiao.com/timu_id_3957262[举报]
某同学用如下实验装置及化学药品制取氨气并研究氨气的催化氧化.
请你按要求回答下列问题:
(1)该同学制取氨气的化学方程式为
(2)检验氨气是否收集满的方法是(简述操作方法、现象和结论)
(3)一段时间后,将收集氨气的试管倒立在水槽中,观察到试管内液面最终只上升到试管的一半.若不考虑试管内溶质扩散到水槽中,则标准状况下,试管内溶液的物质的量浓度为
(4)用B装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入B装置的锥形瓶内,写出锥形瓶内氨氧化的化学方程式
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、
查看习题详情和答案>>

请你按要求回答下列问题:
(1)该同学制取氨气的化学方程式为
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(2)检验氨气是否收集满的方法是(简述操作方法、现象和结论)
将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满)
将湿润的红色石蕊试纸置于管口,若试纸变蓝,则说明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满)
.(3)一段时间后,将收集氨气的试管倒立在水槽中,观察到试管内液面最终只上升到试管的一半.若不考虑试管内溶质扩散到水槽中,则标准状况下,试管内溶液的物质的量浓度为
0.045mol/L
0.045mol/L
.(4)用B装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入B装置的锥形瓶内,写出锥形瓶内氨氧化的化学方程式
4NH3十5O2
4NO+6H2O
| ||
| △ |
4NH3十5O2
4NO+6H2O
.
| ||
| △ |
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、
NH4+
NH4+
、NO3-
NO3-
离子.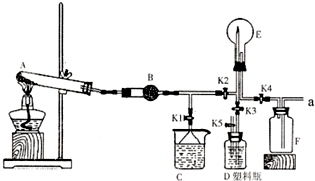 如图是实验室中某种气体的制备、性质检验及收集装置图.
如图是实验室中某种气体的制备、性质检验及收集装置图.(1)写出A装置中反应的化学方程式
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(2)B装置的作用是
干燥氨气
干燥氨气
.(3)做喷泉实验前,要检验F装置是否充满气体,该操作及现象是
用湿润的红色石蕊试纸靠近a处,如试纸变为蓝色,则F中的已充满氨气(或用玻璃棒蘸取浓盐酸靠近a处,如产生白烟,则F中充满氨气)
用湿润的红色石蕊试纸靠近a处,如试纸变为蓝色,则F中的已充满氨气(或用玻璃棒蘸取浓盐酸靠近a处,如产生白烟,则F中充满氨气)
.(4)做喷泉实验时要关闭K2和K4,打开K1,此时C装置的作用有两点:①吸收多余的气体保证气流通畅.②
防止发生倒吸现象
防止发生倒吸现象
.(5)验满气体后,关闭K2和K4,打开K1.若要在E中引发喷泉,其操作为
关闭K5,打开K3,轻轻挤压塑料瓶D,然后打开K5(或打开K1和K5,用手(或热毛巾、或冷毛巾将烧瓶捂住)
关闭K5,打开K3,轻轻挤压塑料瓶D,然后打开K5(或打开K1和K5,用手(或热毛巾、或冷毛巾将烧瓶捂住)
;假设液体充满整个烧瓶,在标准状况下所得溶液的物质的量浓度为0.045mol/L
0.045mol/L
.(2011?德州一模)在实验室中用下列装置进行有关实验探究.请回答下列问题:
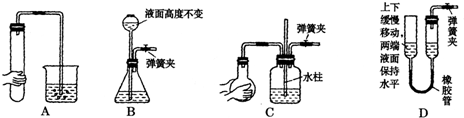
Ⅰ.气体制备时需检查装置的气密性,如下图所示各装置,肯定不符合气密性检查要求的是
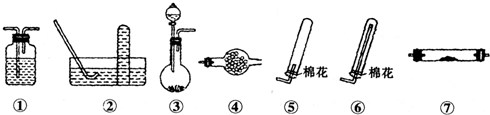
Ⅱ.若用下列装置③制取并收集干燥的NH3,烧瓶内装的试剂是
Ⅲ.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品.
②有关物质的部分性质如下表:
设计实验装置图如下:
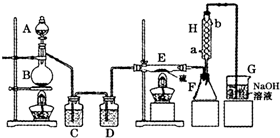
(1)B中反应的离子方程式:
(2)H中冷水的方向为
(3)为了提高S2Cl2的纯度,关键的操作是控制好温度和
(4)尾气处理装置存在明显的缺陷,如何改正:
查看习题详情和答案>>
Ⅰ.气体制备时需检查装置的气密性,如下图所示各装置,肯定不符合气密性检查要求的是
D
D
.
Ⅱ.若用下列装置③制取并收集干燥的NH3,烧瓶内装的试剂是
生石灰
生石灰
.收集装置应选择⑥
⑥
(填装置序号).证明氨气已收集满的操作是将湿润的红色石蕊试纸靠近瓶口,试纸变蓝(或将蘸有浓盐酸的玻璃棒靠近瓶口,有白烟生成)
将湿润的红色石蕊试纸靠近瓶口,试纸变蓝(或将蘸有浓盐酸的玻璃棒靠近瓶口,有白烟生成)
.
Ⅲ.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品.
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点℃ | 化学性质 | ||||
| S | 112.8 | 444.6 | 略 | ||||
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S;300℃以上完全分解; S2Cl2+Cl2
|

(1)B中反应的离子方程式:
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;
| ||
(2)H中冷水的方向为
a
a
进b
b
出.(3)为了提高S2Cl2的纯度,关键的操作是控制好温度和
控制浓盐酸的滴速不要过快
控制浓盐酸的滴速不要过快
.(4)尾气处理装置存在明显的缺陷,如何改正:
在G和H之间增加干燥装置;G中加防倒吸装置
在G和H之间增加干燥装置;G中加防倒吸装置
.工业合成氨气的成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
(1)下图装置中能用于实验室制NH3的是

(2)写出用NH4Cl和Ca(OH)2制取氨气的反应方程式:
(3)检验集气瓶收集满氨气的方法
(4)NH3在工业上除作为制作化肥的原料外,也常用来制取硝酸,其主要步骤为:NH3
NO
NO2
HNO3
请写出下列反应的化学方程式:
NH3→NO:
Cu和浓硝酸反应:
查看习题详情和答案>>
(1)下图装置中能用于实验室制NH3的是
A
A
;用向下排空气
向下排空气
法收集氨气
(2)写出用NH4Cl和Ca(OH)2制取氨气的反应方程式:
2NH4Cl+Ca(OH)2
CaCl2+2NH3 ↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3 ↑+2H2O
.
| ||
(3)检验集气瓶收集满氨气的方法
用湿润的红色石蕊试纸放到试管口,如果变蓝,则氨气已收集满;或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气已收集满.
用湿润的红色石蕊试纸放到试管口,如果变蓝,则氨气已收集满;或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气已收集满.
.(4)NH3在工业上除作为制作化肥的原料外,也常用来制取硝酸,其主要步骤为:NH3
| ① |
| ② |
| ③ |
请写出下列反应的化学方程式:
NH3→NO:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
| ||
| △ |
Cu和浓硝酸反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.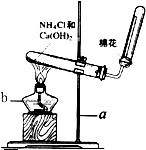 实验室常用下图装置制取氨气:请回答下列问题:
实验室常用下图装置制取氨气:请回答下列问题:(1)写出图中带有编号的仪器名称a
铁架台
铁架台
b酒精灯
酒精灯
.(2)写出该实验中制取氨气的化学方程式:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(3)检验氨气是否收集满的方法是
用湿润的红色石蕊试纸放到试管口,如果变蓝,则氨气已收集满;或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气已收集满
用湿润的红色石蕊试纸放到试管口,如果变蓝,则氨气已收集满;或用玻璃棒蘸取浓盐酸靠近试管口处,若观察到白烟,则氨气已收集满
.(4)不用排水法收集氨气的原因是:
氨气极易溶于水
氨气极易溶于水
. (5)试管口棉花的作用是:
防止空气对流,使收集的氨气纯净
防止空气对流,使收集的氨气纯净
.