网址:http://m.1010jiajiao.com/timu_id_3948883[举报]
|
在密闭容器中,对已达到化学平衡的反应:2A(g)+2B(g) ①恒温恒容条件下,充入不参与反应的气体He,平衡不移动,各种气体的体积分数不变 ②恒温恒压条件下,充入不参与反应的气体He,平衡正向移动,则可知x>3 ③恒容条件下,给体系升温,正反应速率和逆反应速率都增大,逆反应速率增大得多些 ④恒容条件下,给体系降温,混合气体的平均相对分子质量一定增大 ⑤改变某一条件,使平衡正向移动,则反应物A的转化率一定增大 ⑥加压压缩容器体积,平衡先逆向移动,后又正向移动,则C或D至少有一种变为非气态 ⑦改变某一条件,只要平衡正向移动,则逆反应速率一定减小 | |
| [ ] | |
A. |
①③⑤ |
B. |
②④⑥ |
C. |
②③⑥ |
D. |
③⑤⑦ |
已知反应①Fe(s)+CO2(g)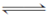 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2. 40 |
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900 ℃
D.使用合适的催化剂 E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2 b.体系压强保持不变
c.v正(O2)=v逆(CO2) d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变 f.CO和O2的体积比保持不变 查看习题详情和答案>>
化学反应原理:
(14分)近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为: ;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH= 。
![]() (4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
(4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是 (用含a、b的数学式表示)。
查看习题详情和答案>>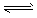 FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。(1)能判断该反应达到平衡状态的依据是___________(填序号)。
A.容器内压强不变了
B.c(CO)不变了
C.v正(CO2)=v逆(CO)
D.c(CO2)=c(CO)
(2)该反应的正反应是_______(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:
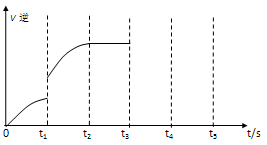
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线。
I.已知:反应




请回答:
 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应

 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应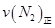 ____________
____________ (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:

 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:

请完成下列问题:
①判断该反应的 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A. B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
查看习题详情和答案>>