网址:http://m.1010jiajiao.com/timu_id_3932219[举报]
强酸弱碱盐:弱碱阳离子由于发生水解生成相对应的
________,使溶液呈________性,如CuSO4、NH4Cl、Fe(NO3)3等.试写出CuSO4、NH4Cl在水溶液中水解的离子方程式________、________; 酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:
酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:(1)NaOH(2)CH3COOH(3)NH4Cl(4)NH3?H2O(5)CH3COONa请回答下列问题:(1)上述几种电解质中属于弱电解质的是
(2)常温下0.01mol/L NaOH溶液的PH=
(3)用离子方程式表示NH4Cl溶液呈酸性的原因
(4)将等PH等体积的NaOH和NH3?H2O分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m
(5)常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
②K点对应的溶液中,c(M+)+c(MOH)
酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:(1)NaOH(2)CH3COOH(3)NH4Cl(4)NH3·H2O(5)CH3COONa请回答下列问题: (1)上述几种电解质中属于弱电解质的是 ,溶液呈酸性的有 (填序号) (2)常温下0.01mol/L NaOH溶液的PH= ;PH=11的CH3COONa溶液中由水电离产生的c(OH-) = (3)用离子方程式表示NH4Cl溶液呈酸性的原因 ,其溶液中离子浓度按由大到小的顺序为 (4)将等PH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”) (5)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: 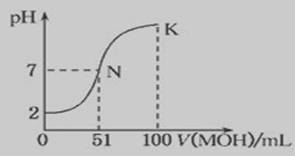
①由图中信息可知HA为________酸(填“强”或“弱”),理由是____________ 。
② K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”)。
查看习题详情和答案>>