摘要:递变规律:熔点.沸点逐渐降低.密度呈增大趋势()
网址:http://m.1010jiajiao.com/timu_id_3931679[举报]
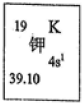 我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其原子核外有
(3)上述反应生成物中,属于非电解质的是
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为
A.最高价氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.其两两组合形成的化合物中元素的化合价
(5)、上述反应中,如1.5mol还原剂
有四种短周期元素的部分性质如下,请根据有关信息填空:
注:气体密度已换算为标准状况
(1)元素W在周期表中的位置
(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为
 ,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
查看习题详情和答案>>
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
(1)元素W在周期表中的位置
第三周期第ⅠA族
第三周期第ⅠA族
,根据性质描述,元素Z的单质是石墨
石墨
(写名称),上述元素的简单离子中半径最小的是Na+
Na+
(写离子符号).(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
HF>HCl>H2S
HF>HCl>H2S
(用化学式表示).(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
b
b
(选填序号).a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为


C(s)+O2(g)=CO2△H=-393.51kJ/mol
C(s)+O2(g)=CO2△H=-393.51kJ/mol
.根据元素性质递变规律,下列判断正确的是( )
| A、酸性:HI>HBr>HCl;碱性:NaOH>KOH>RbOH | B、沸点: ;熔点:Na<K<Rb ;熔点:Na<K<Rb | C、可燃性:H2O<NH3<CH4;还原性:HCl<H2S<PH3 | D、还原性:Na>Mg>Al;氧化性:P>S>Cl2 |
(2012?信阳二模)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2
2NaH).生成物氢化钠的电子式为
 ,含有的化学键类型为
,含有的化学键类型为
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是
a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是
(4)元素Cl与S元素相比,非金属性较强的是
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态 d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:根据表中数据,归纳共价键键能与键长的关系
查看习题详情和答案>>
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2
| 一定条件 |


离子键
离子键
键(填“离子”、“共价”或“金属”).(2)元素周期表中元素的性质存在递变规律,下列比较正确的是
c
c
.a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是
HCl>H2S>PH3>SiH4
HCl>H2S>PH3>SiH4
.(4)元素Cl与S元素相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列表述中能证明这一事实的是bc
bc
.a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态 d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是
HF分子之间存在氢键
HF分子之间存在氢键
.(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:根据表中数据,归纳共价键键能与键长的关系
同主族元素原子与相同其他原子形成的共价键,键长越小,键能越大
同主族元素原子与相同其他原子形成的共价键,键长越小,键能越大
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 341 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |