摘要:2.氧气的实验室制法 A.药品:KClO3和MnO2或KMnO4 B.反应条件:加热 C.反应原理:① 2KClO3 2KCl +3O2↑ ② 2KMnO4 K2MnO4 +MnO2 +O2↑ D.实验装置: ①试管口略向下倾斜.防止水倒流.致使试管炸裂. ②铁夹夹在离试管口1/3处. ③试管内导管刚露出橡皮塞即可.便于导出气体. ④用高锰酸钾制氧气时.试管口应放一团棉花.防止加热时高锰酸钾小颗粒随气流进入导管. ⑤用排水法收集氧气时.导管伸到集气瓶口即可,用向上排空气法收集氧时.导管应伸入集气瓶中.接近瓶底部.便于排尽瓶中的空气. ⑥检验:将带火星的木条伸入集气瓶中.若木条复燃.说明瓶内气体是氧气. ⑦收集方法:用排水法或向上排空气法. ⑧验满:用排水法收集氧气.当看到集气瓶口处有气泡向外逸出.说明瓶中集满氧气,用向上排空气法收集氧气时.验满时.将带火星的木条放在集气瓶口处.木条复燃.说明氧气已满. ⑨操作步骤:组装仪器-检气密性-装药-固定-加热-收集-移导管-熄火 ⑩排水法收集完毕后.必须先将导管从水槽中取出.然后再熄灭酒精灯.否则.水槽内水会倒吸入试管内.引起试管炸裂.集满氧气的集气瓶应用毛玻璃片盖住.正放在桌上.
网址:http://m.1010jiajiao.com/timu3_id_94699[举报]
(2013?南沙区一模)通过一年的学习,我们知道了氧气的实验室制法有多种途径.结合下列装置图,按要求回答问题.

(1)请你在③处写出另一种实验室制取氧气的方法.
①加热氯酸钾和二氧化锰的混合物 ②分解过氧化氢溶液 ③
(2)检查装置B气密性的方法
(3)若用方法A制取氧气,写出反应的化学方程式
(4)过氧化钙固体和水反应也会产生氧气.化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑该反应的气体发生装置应选
查看习题详情和答案>>

(1)请你在③处写出另一种实验室制取氧气的方法.
①加热氯酸钾和二氧化锰的混合物 ②分解过氧化氢溶液 ③
加热高锰酸钾
加热高锰酸钾
(2)检查装置B气密性的方法
用弹簧夹夹紧乳胶管,向长颈漏斗中注入一定量的水,会形成一段稳定的液注,则装置的气密性良好
用弹簧夹夹紧乳胶管,向长颈漏斗中注入一定量的水,会形成一段稳定的液注,则装置的气密性良好
(3)若用方法A制取氧气,写出反应的化学方程式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
| ||
| △ |
(4)过氧化钙固体和水反应也会产生氧气.化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑该反应的气体发生装置应选
B
B
;收集较纯净的氧气应选E
E
(填写字母序号).通过学习,小明知道了氧气的实验室制法有多种途径.结合下列装置图,按要求回答问题.
(1)写出标号仪器的名称:a
(2)小红将A与E相连,拿掉棉花用氯酸钾和二氧化锰加热制取氧气.实验操作有:a.停止加热;b.装入药品;c.加热,收集气体;d.固定试管;e.将导管从水槽中取出; 上述过程中缺少的一步操作是
顺序是:
(3)小明了解到,向鱼池中撒入过氧化钙【CaO2】固体可增加鱼池中的含氧量.经查阅资料:过氧化钙与水反应生成氢氧化钙和氧气,试写出该反应的化学方程式:

查看习题详情和答案>>
(1)写出标号仪器的名称:a
长颈漏斗
长颈漏斗
.若用加热高锰酸钾制取氧气,写出反应的化学方程式2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
应选用的气体发生装置
| ||
A
A
(填写字母序号,下同),若要收集一瓶比较干燥的氧气应选用的收集装置C
C
(2)小红将A与E相连,拿掉棉花用氯酸钾和二氧化锰加热制取氧气.实验操作有:a.停止加热;b.装入药品;c.加热,收集气体;d.固定试管;e.将导管从水槽中取出; 上述过程中缺少的一步操作是
检查装置气密性
检查装置气密性
,将该操作编号为f,则正确的操作顺序是:
fbdcea
fbdcea
小红制取氧气的化学方程式为:2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
| ||
| △ |
(3)小明了解到,向鱼池中撒入过氧化钙【CaO2】固体可增加鱼池中的含氧量.经查阅资料:过氧化钙与水反应生成氢氧化钙和氧气,试写出该反应的化学方程式:
2CaO2+2H2O=2Ca(OH)2+O2↑
2CaO2+2H2O=2Ca(OH)2+O2↑

某班级的几个兴趣小组用如下图中学化学实验常见的实验装置探究氧气的实验室制法
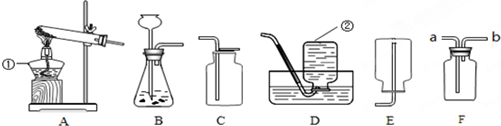
(1)请写出有标号仪器的名称:①
(2)甲小组用过氧化氢溶液和二氧化锰反应制取较纯净的氧气,发生装置和收集装置是
(3)乙小组用氯酸钾和二氧化锰混合物制取氧气,反应的化学方程式是
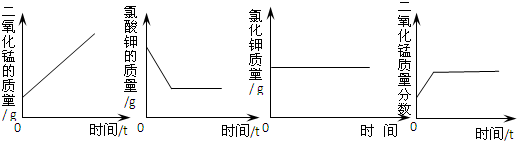
【实验过程】:称取-定质量的氯酸钾和二氧化锰混合物16.0g,放入大试管中加热至质量不再变化为止,称得固体质量为11.2g.
【数据处理】:①根据质量守恒定律,计算得到氧气的质量为
【反思应用】:下列图象能正确表示上述实验过程的是
(4)丙小组用高锰酸钾制取氧气,他们称取一定质量的高锰酸钾固体放入A装置中,指出A装置的不足之处是
【提出猜想】
猜想Ⅰ:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2MnO4分解放出O2;
猜想Ⅲ:反应生成的K2MnO4和MnO2分解放出O2.
【实验验证】:同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想
第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是
【拓展延伸】:实验发现,用氯酸钾固体加热制取氧气的反应速率很慢,但如果将高锰酸钾固体与氯酸钾固体混合加热,则氯酸钾的分解速率大大加快,请说明高锰酸钾在氯酸钾的分解反应中是否作催化剂,为什么?
查看习题详情和答案>>

(1)请写出有标号仪器的名称:①
酒精灯
酒精灯
;②集气瓶
集气瓶
.(2)甲小组用过氧化氢溶液和二氧化锰反应制取较纯净的氧气,发生装置和收集装置是
BD
BD
,其化学方程式是2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.收集氧气也可用F装置,气体应从
| ||
a
a
(填“a”或“b”)端管口通入.(3)乙小组用氯酸钾和二氧化锰混合物制取氧气,反应的化学方程式是
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
,二氧化锰在其中起
| ||
| △ |
催化
催化
作用,化学反应前后,二氧化锰的质量
质量
和化学性质
化学性质
不变.为了测定一定质量的氯酸钾产生氧气的量,乙小组还进行了如下实验研究:【实验过程】:称取-定质量的氯酸钾和二氧化锰混合物16.0g,放入大试管中加热至质量不再变化为止,称得固体质量为11.2g.
【数据处理】:①根据质量守恒定律,计算得到氧气的质量为
4.8
4.8
g.②列式计算混合物中氯酸钾的质量.【反思应用】:下列图象能正确表示上述实验过程的是
D
D
.
(4)丙小组用高锰酸钾制取氧气,他们称取一定质量的高锰酸钾固体放入A装置中,指出A装置的不足之处是
试管口没有棉花团
试管口没有棉花团
,将装置改进后,将温度控制在250℃加热制取O2.实验结束时,乙同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:【提出猜想】
猜想Ⅰ:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2MnO4分解放出O2;
猜想Ⅲ:反应生成的K2MnO4和MnO2分解放出O2.
【实验验证】:同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想
Ⅰ
Ⅰ
错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是
用带火星的木条放入在试管中,木条复燃
用带火星的木条放入在试管中,木条复燃
.【拓展延伸】:实验发现,用氯酸钾固体加热制取氧气的反应速率很慢,但如果将高锰酸钾固体与氯酸钾固体混合加热,则氯酸钾的分解速率大大加快,请说明高锰酸钾在氯酸钾的分解反应中是否作催化剂,为什么?
高锰酸钾不是催化剂;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,其中使氯酸钾的分解速率大大加快的是分解出的二氧化锰,而不是高锰酸钾
高锰酸钾不是催化剂;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,其中使氯酸钾的分解速率大大加快的是分解出的二氧化锰,而不是高锰酸钾
.(2012?乌鲁木齐)通过一年的学习,小明知道了氧气的实验室制法有多种途径.结合下列装置图,按要求回答问题.

(1)请你在C处写出另一种实验室制取氧气的方法.
A.加热高锰酸钾 B.分解过氧化氢溶液 C.
(2)写出标号仪器的名称:a
(3)小明了解到,向鱼池中撒入过氧化钙固体可增加鱼池中的含氧量.
【提出问题】实验室能否用过氧化钙固体与水反应制取氧气?
【查阅资料】2CaO2+2H2O=2Ca(OH)2+O2↑
【实验结论】
【分析与反思】过氧化钙与水反应“开始有较多细小气泡放出,随后放出气泡的速度减缓”的原因可能是
查看习题详情和答案>>

(1)请你在C处写出另一种实验室制取氧气的方法.
A.加热高锰酸钾 B.分解过氧化氢溶液 C.
加热氯酸钾
加热氯酸钾
(2)写出标号仪器的名称:a
长颈漏斗
长颈漏斗
.若用加热高锰酸钾制取氧气,写出反应的化学方程式2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,应选用的气体发生装置
| ||
A
A
(填写字母序号,下同).(3)小明了解到,向鱼池中撒入过氧化钙固体可增加鱼池中的含氧量.
【提出问题】实验室能否用过氧化钙固体与水反应制取氧气?
【查阅资料】2CaO2+2H2O=2Ca(OH)2+O2↑
| 实验装置的选择 | 实验主要过程及现象 |
| 气体发生装置应选 B B 收集较纯净的氧气应选 E E |
检查装置的气密性,将水加入过氧化钙中,开始有较多细小气泡放出,随后放出气泡的速度减缓,只收集到极少量气体.该装置放置到第二天,集气瓶中只收集到少量气体,振荡后又有少量细小气泡缓慢放出 |
不宜用过氧化钙固体与水反应制取氧气
不宜用过氧化钙固体与水反应制取氧气
.【分析与反思】过氧化钙与水反应“开始有较多细小气泡放出,随后放出气泡的速度减缓”的原因可能是
反应生成的氢氧化钙微溶于水,覆盖在过氧化钙的表面,阻碍反应的进行
反应生成的氢氧化钙微溶于水,覆盖在过氧化钙的表面,阻碍反应的进行
.(2013?德惠市二模)某班学生参加了化学实验技能考查.

(l)小虎抽到的题目是“氧气的实验室制法--用加热高锰酸钾的方法制取氧气”:
①图1中a仪器的名称是
②小虎从图中选取的装置是
③该反应的化学方程式是
④B装置中的棉花的作用是
(2)小光抽到的题目是“二氧化碳的实验室制法”.实验室准备了药品和如图2所示的常用仪器:

药品:稀盐酸、块状石灰石、碳酸钠粉末、澄清石灰水
小光第一步选择仪器组装好发生装置;第二步向组装好的装置中加入足量药品,观察到反应非常剧烈,且迅速停止;第三步收集二氧化碳并验满.
①第一步小光不需要用的仪器名称是
②第二步小光选取的固体药品是
③第三步小光验满的操作方法是
④小光操作考试中缺少的实验步骤是
查看习题详情和答案>>

(l)小虎抽到的题目是“氧气的实验室制法--用加热高锰酸钾的方法制取氧气”:
①图1中a仪器的名称是
水槽
水槽
;②小虎从图中选取的装置是
BD或BE
BD或BE
;(填序号)③该反应的化学方程式是
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
;
| ||
④B装置中的棉花的作用是
防止高锰酸钾粉末堵塞导管
防止高锰酸钾粉末堵塞导管
.(2)小光抽到的题目是“二氧化碳的实验室制法”.实验室准备了药品和如图2所示的常用仪器:

药品:稀盐酸、块状石灰石、碳酸钠粉末、澄清石灰水
小光第一步选择仪器组装好发生装置;第二步向组装好的装置中加入足量药品,观察到反应非常剧烈,且迅速停止;第三步收集二氧化碳并验满.
①第一步小光不需要用的仪器名称是
酒精灯
酒精灯
;②第二步小光选取的固体药品是
碳酸钠粉末
碳酸钠粉末
;③第三步小光验满的操作方法是
用燃着的木条放置在集气瓶口,若木条熄灭则收集满;
用燃着的木条放置在集气瓶口,若木条熄灭则收集满;
;④小光操作考试中缺少的实验步骤是
检查装置的气密性
检查装置的气密性
.