摘要:20.以水氯镁石(主要成分为)为原料生产碱式碳酸镁的主要流程如下: (l)预氨化过程中有Mg(OH)2沉淀生成.已知常温下Mg(OH)2的.若溶液中.则溶液中= . (2)上述流程中的滤液浓缩结晶.所得主要固体物质的化学式为 . (3)高温煅烧碱式碳酸镁得到.取碱式碳酸镁4.66g.高温煅烧至恒重.得到固体2.00g和标准状况下0.896L.通过计算确定碱式碳酸镁的化学式. (4)若热水解不完全.所得碱式碳酸镁中将混有.则产品中镁的质量分数 ▲ (填 “升高 .“降低 或“不变 ). [答案] (1)2.0mol.L-1 (2)NH4Cl 24MgCO34H2O (4)升高 [解析]本题主要考查的是有关Ksp的计算和无机化工流程和化学计算.(1)依据Ksp计算的公式可知c(Mg2+)=Ksp/c2(OH-)= 2.0mol/L,(2)通过流程分析.最后 综上分析可知.滤液中的主要成分为NH4Cl.浓缩以后得到的固体物质为NH4Cl,(3)根据题给相关物质的数据可有以下计算 所以..从而得到其化学组成为,Mg(OH)24MgCO34H2O (4)因为MgCO3中Mg的含量比碱式碳酸镁的含量高.因此.混有MgCO3后.Mg的含量升高.
网址:http://m.1010jiajiao.com/timu3_id_88328[举报]
以水氯镁石为原料生产碱式碳酸镁的主要流程如下:

(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol?L-1,则溶液中c(Mg2+)=______.
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为______.
(3)高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式.
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”).
查看习题详情和答案>>

(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol?L-1,则溶液中c(Mg2+)=______.
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为______.
(3)高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式.
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”).
查看习题详情和答案>>
镁及其化合物在生产生活中有重要的作用.以水氯镁石为原料生产碱式碳酸镁的主要流程如下:

(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为______.指出该物质在工农业生产中的一种用途:______.
(2)写出预氨化时发生的主要反应的离子方程式:______.
(3)沉淀镁时反应的温度不宜过高,原因是______.
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③______;④______;⑤称量MgO.18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:a=______;b=______;c=______.
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是______.理由是______.
查看习题详情和答案>>

(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为______.指出该物质在工农业生产中的一种用途:______.
(2)写出预氨化时发生的主要反应的离子方程式:______.
(3)沉淀镁时反应的温度不宜过高,原因是______.
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③______;④______;⑤称量MgO.18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:a=______;b=______;c=______.
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是______.理由是______.
查看习题详情和答案>>
(2011?宣城二模)镁及其化合物在生产生活中有重要的作用.以水氯镁石(主要成分为MgCl2?6H2O)为原料生产碱式碳酸镁的主要流程如下:
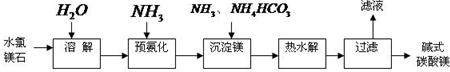
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为
(2)写出预氨化时发生的主要反应的离子方程式:
(3)沉淀镁时反应的温度不宜过高,原因是
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是
查看习题详情和答案>>

(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为
NH4Cl
NH4Cl
.指出该物质在工农业生产中的一种用途:做氮肥(或其他合理答案)
做氮肥(或其他合理答案)
.(2)写出预氨化时发生的主要反应的离子方程式:
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
.(3)沉淀镁时反应的温度不宜过高,原因是
防止碳酸氢铵分解
防止碳酸氢铵分解
.(4)设计一个实验,确定产品碱式碳酸镁aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③
测出CO2的质量
测出CO2的质量
;④测出水蒸气的质量
测出水蒸气的质量
;⑤称量MgO.18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:a=3
3
;b=1
1
;c=3
3
.(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是
不同意
不同意
.理由是因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
.(2010?江苏)以水氯镁石(主要成分为MgCl2?6H2O)为原料生产碱式碳酸镁的主要流程如下:

(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol?L-1,则溶液中c(Mg2+)=
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为
(3)高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式.
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数
查看习题详情和答案>>

(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol?L-1,则溶液中c(Mg2+)=
2.0mol?L-1
2.0mol?L-1
.(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为
NH4Cl
NH4Cl
.(3)高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式.
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数
升高
升高
(填“升高”、“降低”或“不变”).(14分)镁及其化合物在生产生活中有重要的作用。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。指出该物质在工农业生产中的一种用途: 。
(2)写出预氨化时发生的主要反应的离子方程式: 。
(3)沉淀镁时反应的温度不宜过高,原因是 。
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③ ;④ ;⑤称量MgO。
18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a= ;b = ;c = 。
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁。有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则。你同意该同学的想法吗?为什么?你的观点是 。理由是 。