题目内容
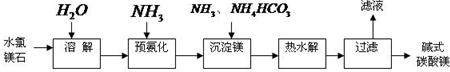
以水氯镁石为原料生产碱式碳酸镁的主要流程如下:
(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol?L-1,则溶液中c(Mg2+)=______.
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为______.
(3)高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式.
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数 (填“升高”、“降低”或“不变”).
【答案】分析:(1)根据溶度积表达式Ksp=[Mg2+][OH-]2进行计算;
(2)根据流程判断所得滤液的成分中含有的离子,确定滤液中的物质来回答;
(3)根据碳酸镁的分子式,可以写成氧化物的表示形式,即2MgO?H2O?CO2,然后根据题意确定各个氧化物的量,进而确定分子式.
(4)根据同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大来回答.
解答:解:(1)根据溶度积表达式Ksp=[Mg2+][OH-]2得[Mg2+]= =2.0 mol?L-1,故答案为:2.0 mol?L-1
=2.0 mol?L-1,故答案为:2.0 mol?L-1
(2)根据流程判断所得滤液的成分中含有的离子有氯离子和铵根离子,故所得的滤液中含NH4Cl,故答案为:NH4Cl;
(3)碳酸镁的分子式,可以写成氧化物的表示形式,即2MgO?H2O?CO2;各个氧化物的量分别为:


故:n(MgO):n(CO2):n(H2O)=5.00×10-2:4.00×10-2:5.00×10-2=5:4:5,故碱式碳酸镁的化学式为:Mg(OH)2?4MgCO3?4H2O;
(4)同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大,即产品中镁的质量就大,故答案为:升高.
点评:本题是一道工业生产题,考查了沉淀溶解平衡的知识以及元素守恒思想的应用,是一道综合型题目.
(2)根据流程判断所得滤液的成分中含有的离子,确定滤液中的物质来回答;
(3)根据碳酸镁的分子式,可以写成氧化物的表示形式,即2MgO?H2O?CO2,然后根据题意确定各个氧化物的量,进而确定分子式.
(4)根据同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大来回答.
解答:解:(1)根据溶度积表达式Ksp=[Mg2+][OH-]2得[Mg2+]=
 =2.0 mol?L-1,故答案为:2.0 mol?L-1
=2.0 mol?L-1,故答案为:2.0 mol?L-1(2)根据流程判断所得滤液的成分中含有的离子有氯离子和铵根离子,故所得的滤液中含NH4Cl,故答案为:NH4Cl;
(3)碳酸镁的分子式,可以写成氧化物的表示形式,即2MgO?H2O?CO2;各个氧化物的量分别为:



故:n(MgO):n(CO2):n(H2O)=5.00×10-2:4.00×10-2:5.00×10-2=5:4:5,故碱式碳酸镁的化学式为:Mg(OH)2?4MgCO3?4H2O;
(4)同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大,即产品中镁的质量就大,故答案为:升高.
点评:本题是一道工业生产题,考查了沉淀溶解平衡的知识以及元素守恒思想的应用,是一道综合型题目.

练习册系列答案
相关题目