摘要:6.如右图所示中a曲线表示一定条件下可逆反应X 2Z的反应过程.若使a曲线变为b曲线.可采取的措施是 ( ) A.加入催化剂 B.增大Y的浓度 C.降低温度 D.增大体系压强 [解析] 使用催化剂.可以加快化学反应速率.缩短达到平衡所需时间.但催化剂并不影响化学平衡.故反应物的转化率.生成物的产率.反应混合物的组成都不变.该反应是一个气体体积不变的反应.增大压强.平衡不移动.但增大压强.各物质的浓度增大.化学反应速率增大.达到平衡所需时间短.所以.A.D选项符合题意. [答案] AD
网址:http://m.1010jiajiao.com/timu3_id_88159[举报]
 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)回答下列问题:
(1)若降低温度,该反应的化学平衡常数
增大
增大
.(填“增大”“减小”或“不变”)(2)该反应处于平衡状态的时间段为
15-20min、25-30min
15-20min、25-30min
.(3)反应进行至20min时,曲线发生变化的原因是
增大氧气的浓度
增大氧气的浓度
(用文字表达).10min到15min的曲线变化的原因可能是a、b
a、b
(填写编号).a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气,则平衡
不
不
( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体,则平衡向左
向左
( 填“向左”或“向右”或“不”) 移动.一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)
2SO3(g),△H<0.反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1)若降低温度,该反应的化学平衡常数______.(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为______.
(3)反应进行至20min时,曲线发生变化的原因是______ (用文字表达).10min到15min的曲线变化的原因可能是______ (填写编号).
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气,则平衡______( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体,则平衡______( 填“向左”或“向右”或“不”) 移动.
查看习题详情和答案>>
回答下列问题:
(1)若降低温度,该反应的化学平衡常数______.(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为______.
(3)反应进行至20min时,曲线发生变化的原因是______ (用文字表达).10min到15min的曲线变化的原因可能是______ (填写编号).
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气,则平衡______( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体,则平衡______( 填“向左”或“向右”或“不”) 移动.

一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:

回答下列问题:
(1) 若降低温度,该反应的化学平衡常数 。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气 , 则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则平衡 ( 填“向左”或“向右”或“不”) 移动。
查看习题详情和答案>>
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0.反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0.反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1)若降低温度,该反应的化学平衡常数 .(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 .
(3)反应进行至20min时,曲线发生变化的原因是 (用文字表达).10min到15min的曲线变化的原因可能是 (填写编号).
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气,则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体,则平衡 ( 填“向左”或“向右”或“不”) 移动.
 查看习题详情和答案>>
查看习题详情和答案>>
 2SO3(g),△H<0.反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0.反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
(1)若降低温度,该反应的化学平衡常数 .(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 .
(3)反应进行至20min时,曲线发生变化的原因是 (用文字表达).10min到15min的曲线变化的原因可能是 (填写编号).
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气,则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体,则平衡 ( 填“向左”或“向右”或“不”) 移动.
 查看习题详情和答案>>
查看习题详情和答案>>
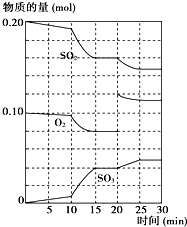 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)写出该反应的化学平衡常数表达式K=
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
增大
增大
,二氧化硫转化率增大
增大
,V正减小
减小
,V逆减小
减小
.(填“增大”“减小”或“不变”)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是
15-20min、25-30min
15-20min、25-30min
.(3)据右图判断,反应进行至20min时,曲线发生变化的原因是
增大氧气的浓度
增大氧气的浓度
(用文字表达);10min到15min的曲线变化的原因可能是ab
ab
(填写编号).a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g)?2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?
否
否
(填“是”或“否”).此时,化学反应速率是v(正)>
>
v(逆)(填“>”、“<”或“=”),原因是反应向正方向进行
反应向正方向进行
.