网址:http://m.1010jiajiao.com/timu3_id_88136[举报]
(1)若在标准状况下有NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为
(2)设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离.
①NOx与NaOH溶液反应的化学方程式:
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元.目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元.则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,求所得利润y(出售价减去成本价,单位:万元)与x的关系式.
4NO+4NO3+O2
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO、NO2的物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
(1)尾气中氮氧化物的平均相对原子量为
(2)要处理5m3的尾气,需要氨氧混合气的体积为
(3)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为
②已知反应后溶液含有0.35mol NaNO2.若将尾气NO和NO2的平均组成用NOx表示,则x=
2NO2+2NaOH====NaNO2+NaNO3+H2O
NO2+NO+2NaOH====2NaNO2+H2O
(1)若在标准状况下有NO、NO2的混合物恰好与50 mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4∶1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离。若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价,硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×109 L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为______________。(附解题过程)
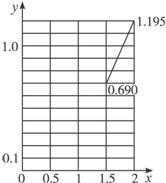
(3)根据(2)的计算结果,在以下坐标系中作出其示意图。
硝酸工业尾气中的氮的氧化物(NO、NO2)是主要的大气污染物,其常用的治理方法有以下两种(已简化)
①NaOH吸收法反应原理如下:2 NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+ H2O
②氨催化还原法 反应原理是:NO2+NH3→N2+H2O
现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体);若用过量的NaOH溶液吸收后溶液中 NaNO3与 NaNO2的物质的量之比恰好与尾气中NO和 NO2的物质的量之比相等。
(1)若用NOx表示该尾气中氮的氧化物的平均组成,试求x的值。
(2)将1体积的该尾气用氨催化还原法处理,至少消耗相同状况下多少体积的氨气?
查看习题详情和答案>>(10分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3 = NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3 = 2NaNO2+CO2↑ ②
(1)若在标准状况下有NO、NO2的混合物恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用纯碱溶液吸收,生成硝酸钠及亚硝酸钠再结晶分离。
①若该混合气体通入纯碱溶液时要求被完全吸收,则x的取值范围应为 。
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×106m3(标准状况)含NOx(x取值范围满足①中要求)体积分数为0.1%的尾气,求所得利润y(出售价减去成本价,单位:万元)与x的关系式。