摘要:2.下列物质①CO2.②CHCl3.③CH4.④CCl4.⑤P4其结构具有正四面体构型的是( ) A.①②③ B.③④⑤ C.②③④ D.①②③④⑤ [解析] CH4和CCl4是以C为中心的正四面体结构.P4是空心的四正面体.CHCl3分子中由于C周围的四个原子不完全相同.其分布不均匀.故不是正四面体.CO2是直线形分子. [答案] B
网址:http://m.1010jiajiao.com/timu3_id_87179[举报]
(1)X原子在第二电子层上只有一个空轨道,则X是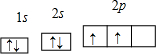
 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是
;R原子的3p轨道上只有一个未成对电子,则R原子可能是
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
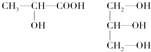
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
查看习题详情和答案>>
C
C
;其轨道表示式为

Al
Al
、Cl
Cl
;Y原子的核电荷数为29,其电子排布式是1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,其在元素周期表中的位置是第四周期第IB族
第四周期第IB族
,是属于ds
ds
区的元素.(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
Co3+
Co3+
、CN-
CN-
、6
6
.(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
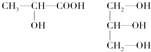
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
①③④⑦
①③④⑦
.(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
>
>
H2SO3; H3PO4>
>
H3PO3.(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
sp3
sp3
杂化,分子的立体构型为V形
V形
.BF3分子中,中心原子的杂化方式为
sp2
sp2
杂化,分子的立体构型为平面正三角形
平面正三角形
.(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
水分子之间存在氢键
水分子之间存在氢键
.
(1)X原子在第二电子层上只有一个空轨道,则X是 (元素名称);其电子排布图为 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 .
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数分别是: 、 、 .
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.

(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号) .
(5)根据价层电子对互斥理论判断下列问题:
H2O分子中,中心原子的杂化方式为 杂化,分子的立体构型为 .
BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为 .
C2H4分子中,中心原子的杂化方式为 杂化,分子的立体构型为 .
C2H2分子中,中心原子的杂化方式为 杂化,分子的立体构型为 .
(6)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于 .
查看习题详情和答案>>
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数分别是:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.

(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)根据价层电子对互斥理论判断下列问题:
H2O分子中,中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
C2H4分子中,中心原子的杂化方式为
C2H2分子中,中心原子的杂化方式为
(6)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
(1)X原子在第二电子层上只有一个空轨道,则X是
 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是
;R原子的3p轨道上只有一个未成对电子,则R原子可能是
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
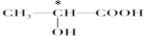
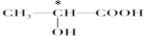
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
查看习题详情和答案>>
C
C
;其轨道表示式为

Al
Al
、Cl
Cl
;Y原子的核电荷数为29,其电子排布式是1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,其在元素周期表中的位置是第四周期第ⅠB族
第四周期第ⅠB族
,是属于ds
ds
区的元素.(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
Co3+
Co3+
、CN-
CN-
、6
6
.(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.

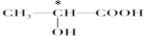
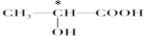
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
①③④⑦
①③④⑦
.(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
>
>
H2SO3; H3PO4>
>
H3PO3.(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
sp3
sp3
杂化,分子的立体构型为V形
V形
.BF3分子中,中心原子的杂化方式为
sp2
sp2
杂化,分子的立体构型为平面正三角形
平面正三角形
.(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
水分子之间存在氢键
水分子之间存在氢键
.(1)X原子在第二电子层上只有一个空轨道,则X是 ;其轨道表示式为 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是 、 ;Y原子的核电荷数为29,其电子排布式是 ,其在元素周期表中的位置是 ,是属于 区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:_________、__________、________。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。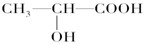
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)________________。
(5) 试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4________H2SO3; H3PO4________H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为 杂化,分子的立体构型为 。
BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为 。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________________________。