摘要:9.常温下.某一元酸HA溶液的pH为b.且有n(A-)∶n(HA)=1∶99.某一元强碱溶液的pH为a.若将1体积的此强碱溶液与10体积的HA溶液混合.恰好完全反应.则a与b之和为( ) A.18 B.17 C.16 D.15 [解析] 根据一元酸HA溶液的pH为b.且有n(A-)∶n(HA)=1∶99.故 [HA]=102-b mol·L-1.[强碱]=10a-14 mol·L-1.恰好完全反应时有[强碱]=10×[HA].解得a+b=17. [答案] B
网址:http://m.1010jiajiao.com/timu3_id_87059[举报]
常温下,某一元强碱溶液的PH为a某一元酸HA溶液的PH值为b,HA的电离度为1.0%,若将1体积此强碱溶液下10体积的HA溶液混合,恰好完全反应,则a与b之和为:
A、14 B、15 C、16 D、17
查看习题详情和答案>>
常温下,将0.05 mol·L-1的盐酸与未知浓度的NaOH溶液以1∶2的体积比混合,所得溶液pH为12。用上述NaOH溶液与20.0 mL的某一元弱酸HA反应,恰好中和时消耗NaOH溶液10.0 mL,所得pH为10。
(1)上述NaOH与HA反应后的溶液中,各离子浓度关系正确的是___________________。
A.c(A-)>c(Na+)>c(H+)>c(OH-) B.c(Na+)>c(A-)>c(OH-)>c(H+)
C.c(A-)>c(OH-)=c(Na+)+c(H+) D.c(Na+)>c(OH-)>c(H+)>c(A-)
(2)试求一元弱酸HA的物质的量浓度_____________________。
(3)盐类水解程度的大小可用“水解度(h)”来表示,对于NaA型盐的水解度(h)为:![]() ×100%。试求上述所得NaA溶液的水解度(h)_________________。
×100%。试求上述所得NaA溶液的水解度(h)_________________。
(4)如果取等物质的量浓度的HA与NaOH按体积比2∶1混合,测得混合溶液的pH>7,则说明HA的电离程度____________NaA的水解程度。(填“大于”“小于”或“等于”)
查看习题详情和答案>>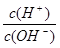 =10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )
=10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )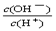 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )