网址:http://m.1010jiajiao.com/timu3_id_86351[举报]
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是
A.液滴中的Cl―由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-![]() 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-![]() Cu2+
Cu2+
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-![]() 4OH-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- = Cu2+
查看习题详情和答案>>
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
A.液滴中的Cl– 由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:
O2+2H2O + 4e![]() =4OH
=4OH![]()
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe 2+由a区向b区迁移,与b区的OH−形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e![]() =Cu2+
=Cu2+
查看习题详情和答案>>
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )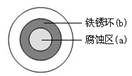
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe 2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+ Cu2+ |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是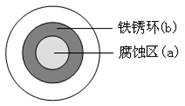
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-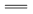 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |