摘要:用于金属焊接的某种焊条.其药皮由大理石.水泥.硅铁等配制而成. (1)Al的原子结构示意图为 ,Al与NaOH溶液反应的离子方程式为 . (2)30Si的原子的中子数为 ,SiO2晶体类型为 . (3)Al3+与Yn-的电子数相同.Y所在族的各元素的氢化物的水溶液均显酸性.则该族氢化物中沸点最低的是 . (4)焊接过程中.药皮在高温下产生了熔渣和使金属不被氧化的气体.该气体是 . (5)经处理后的熔渣36.0g(仅含Fe2O3.Al2O3.SiO2).加入足量稀盐酸.分离得到11.0g固体,滤液中加入过量NaOH溶液.分离得到21.4g固体,则此熔渣中Al2O3的质量分数为 . 解析:本题考察原子的结构.晶体类型.方程式的书写以及有关计算. (1)Al在周期表中位于第三周期第ⅢA族.其原子结构示意图为,单质铝既能与酸反应产生氢气.又能与强碱反应产生氢气.与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑. (2)在原子符合的表达式中左上角表示质量数.左下角表示质子数.根据质量数=质子数+中子数可计算出30Si的原子的中子数为:30-14=16.SiO2晶体是由Si和O两种原子通过极性共价键形成的原子晶体. (3)在元素周期表中只有第 ⅦA族卤素原子的氢化物的水溶液才均显酸性.因为Al3+与Yn-的电子数相同.所以Y是F元素.卤素元素形成的氢化物均属于分子晶体.其沸点随分子间作用力的增大而升高.但由于HF分子中存在氢键.因而HF的沸点最高.所以沸点最低的是HCl. (4)由药皮的成分大理石.水泥.硅铁可知.在高温下只有大理石才分解产生CO2.因此气体只能是CO2气体. (5)熔渣中只有SiO2与盐酸不反应.因此11.0g是SiO2的质量.Fe2O3.Al2O3溶于盐酸分别生成FeCl3.AlCl3.当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2.FeCl3生成Fe(OH)3沉淀.所以21.4g固体是Fe(OH)3的质量.其物质的量为.由铁原子守恒知Fe2O3的物质的量为0.1mol.其质量为0.1mol×160g·mol-1=16.0g.熔渣中Al2O3的质量分数为. 答案:(1) 2Al+2OH-+2H2O=2AlO2-+3H2↑ (2)16 原子晶体 (3)HCl (4)CO2 (5)25%
网址:http://m.1010jiajiao.com/timu3_id_86254[举报]
(2011?重庆)用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
(1)Al的原子结构示意图为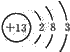
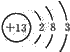 ;Al与NaOH溶液反应的离子方程式为
;Al与NaOH溶液反应的离子方程式为
(2)30Si原子的中子数为
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体.则此熔渣中Al2O3的质量分数为
查看习题详情和答案>>
(1)Al的原子结构示意图为
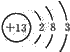
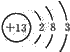
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(2)30Si原子的中子数为
16
16
,SiO2的晶体类型为原子晶体
原子晶体
.(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
HCl
HCl
.(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
CO2
CO2
.(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体.则此熔渣中Al2O3的质量分数为
25%
25%
.用于金属焊接的某种焊条,其药皮由大理石、硅酸盐、硅铁等配制而成.根据题意回答问题:
(1)Al原子的核外电子排布式为 ;Al与NaOH溶液反应的离子方程式为 .
(2)Si原子核外有 种不同能量的电子.硅铁属于合金,它的熔点比纯铁 (填“高”、“低”或“不一定”).
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是 ,最不稳定的是 .
(4)焊接过程中,药皮在高温下产生了熔渣和一种气体,该气体是 ,该气体在固态时属于 晶体.
查看习题详情和答案>>
(1)Al原子的核外电子排布式为
(2)Si原子核外有
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
(4)焊接过程中,药皮在高温下产生了熔渣和一种气体,该气体是
[选修3物质结构与性质]
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
(1)Al的原子基态核外电子排布式
(2)30Si的原子的中子数为
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为
查看习题详情和答案>>
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
(1)Al的原子基态核外电子排布式
1S22S22P63S23P1
1S22S22P63S23P1
;Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2)30Si的原子的中子数为
16
16
;SiO2晶体类型为原子晶体
原子晶体
.(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是
HCl
HCl
.(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体
CO2
CO2
;其杂化类型为SP杂化
SP杂化
.(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为
25%
25%
.(9分)用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为_________。
(2)30Si的原子的中子数为_________;SiO2属于_________(填离子或共价)化合物。
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是______。
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为__________________。
查看习题详情和答案>>