摘要: 氮元素可以形成多种化合物. 回答以下问题: (1)基态氮原子的价电子排布式是 . (2)C.N.O三种元素第一电离能从大到小的顺序是 . (3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物. ①NH3分子的空间构型是 ,N2H4分子中氮原子轨道的杂化类型是 . ②肼可用作火箭燃料.燃烧时发生的反应是: N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1 若该反应中有4mol N-H键断裂.则形成的π键有 mol. ③肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同.则N2H6SO4的晶体内不存在 a. 离子键 b. 共价键 c. 配位键 d. 范德华力 (4)图1表示某种含氮有机化合物的结构.其分子内4个氮原子分别位于正四面体的4个顶点.分子内存在空腔.能嵌入某离子或分子并形成4个氢键予以识别. 下列分子或离子中.能被该有机化合物识别的是 . a. CF4 b. CH4 c. NH4+ d. H2O 解析:(1)基态氮原子的价电子排布式是2s22p3 .学生可能审题时没注意到是价电子排布式. (2)C.N.O三种元素第一电离能从大到小的顺序是N>O>C (3)①NH3分子的空间构型是三角锥型.NH3中氮原子轨道的杂化类型是sp3.而肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的.所以N2H4分子中氮原子轨道的杂化类型是sp3.这个与H2O.H2O2中O的杂化类型都是sp3的道理是一样的. ②反应中有4mol N-H键断裂.即有1molN2H4参加反应.生成1.5molN2.则形成的π键有3mol. ③N2H6SO4晶体类型与硫酸铵相同.可见它是离子晶体.晶体内肯定不存在范德华力. (4)要形成氢键.就要掌握形成氢键的条件:一是要有H原子.二是要电负性比较强.半径比较小的原子比如F.O.N等构成的分子间形成的特殊的分子间作用力.符合这样的选项就是c和d.但题中要求形成4个氢键.氢键具有饱和性.这样只有选c. 这题中的两问亮点较多.让人耳目一新.其中第(4)耐人回味.这样子就把氢键的来龙去脉和特点考查彻底!高! 答案:(1)2s22p3 (2)N>O>C (3)①三角锥形 sP3 ②3 ③d (4)c 17 氧是地壳中含量最多的元素. (1)氧元素基态原子核外未成对电子数为 个. (2)H2O分子内的O-H键.分子间的范德华力和氢键从强到弱依次为 . (3) H+可与H2O形成H3O+.H3O+中O原子采用 杂化.H3O+中H-O-H键角比H2O中H-O-H键角大.原因为 . (4)CaO与NaCl的晶胞同为面心立方结构.已知CaO晶体密度为ag·cm-3.表示阿伏加德罗常数.则CaO晶胞体积为 cm3. 解析:(1)氧元素核外有8个电子.其基态原子核外电子排布为1S22S22P4.所以氧元素基态原子核外未成对电子数为2个, (2)O-H键属于共价键.键能最大,分子间的范德华力和氢键均属于分子间作用力的范畴.但氢键要强于分子间的范德华力.所以它们从强到弱的顺序依次为O-H键.氢键.范德华力,氢键不仅存在于分子之间.有时也存在于分子内.邻羟基苯甲醛在分子内形成氢键.而在分子之间不存在氢键,对羟基苯甲醛正好相反.只能在分子间形成氢键.而在分子内不能形成氢键.分子间氢键强于分子内氢键.所以对羟基苯甲醛的沸点比邻羟基苯甲醛的高. (3)依据价层电子对互斥理论知H3O+中O上的孤对电子对数=1/2=1.由于中心O的价层电子对数共有3+1=4对.所以H3O+为四面体.因此H3O+中O原子采用的是sp3杂化,同理可以计算出H2O中O原子上的孤对电子对数=1/2=2.因此排斥力较大.水中H-O-H键角较小. (4)氯化钠的晶胞如图所示.因此钙晶胞中含有的氯离子个数为8×1/8+6×1/3=4.同样也可以计算出钠离子个数为4.由于CaO与NaCl的晶胞同为面心立方结构.所以CaO晶胞中也含有4个钙离子和4个氧离子.因此CaO晶胞体积为. 答案:(1)2 (2)O-H键.氢键.范德华力,邻羟基苯甲醛形成分子内氢键.而对羟基苯甲醛形成分子间氢键.分子间氢键是分子间作用力增大, (3)sp3,H2O中O原子有2对孤对电子.H3O+只有1对孤对电子.排斥力较小, (4)
网址:http://m.1010jiajiao.com/timu3_id_86253[举报]
氮元素可以形成多种化合物.回答以下问题:
(1)基态氮原子的价电子排布式是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
查看习题详情和答案>>
(1)基态氮原子的价电子排布式是
2s22p3
2s22p3
.(2)C、N、O三种元素第一电离能从大到小的顺序是
N>O>C
N>O>C
.(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
三角锥形
三角锥形
;N2H4分子中氮原子轨道的杂化类型是sp3
sp3
.[化学--物质结构与性质]
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等.
回答以下问题:
(1)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是 .
(2)C、N、O三种元素第一电离能从大到小的顺序是 .
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被一NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是 ; N2H4分子中氮原子轨道的杂化类型是
(4)胼能与硫酸反应生成N2H6S04.N2H6S04晶体类型与硫酸铵相同,则N2H6S04的晶体内不存在 (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(5)NH3、N2H4、NH4+、N2H62+四种微粒中,能形成氢键的有 ;不能作为配位体的有 .
查看习题详情和答案>>
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等.
回答以下问题:
(1)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被一NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
(4)胼能与硫酸反应生成N2H6S04.N2H6S04晶体类型与硫酸铵相同,则N2H6S04的晶体内不存在
a.离子键 b.共价键 c.配位键 d.范德华力
(5)NH3、N2H4、NH4+、N2H62+四种微粒中,能形成氢键的有
(1)氧元素基态原子核外未成对电子数为
(2)氮元素可以形成多种化合物,回答以下问题:
肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的化合物.
N2H4的电子式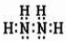
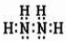 ,氮原子的杂化类型
,氮原子的杂化类型
(3)具有相同的原子总数及相同的价电子总数的分子或离子称为等电子体,等电子体一般具有相似的空间构型. Na3N是汽车防撞气囊中常用的化学物质,请写出与N3-互为等电子体的常见粒子的化学式
查看习题详情和答案>>
2
2
,H+可与H2O形成H3O+,H3O+中氧原子采取sp3
sp3
杂化,H3O+中H-O-H键角比H2O中的H-O-H键角大
大
,原因是H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
.(2)氮元素可以形成多种化合物,回答以下问题:
肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的化合物.
N2H4的电子式
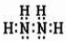
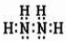
sp3
sp3
.(3)具有相同的原子总数及相同的价电子总数的分子或离子称为等电子体,等电子体一般具有相似的空间构型. Na3N是汽车防撞气囊中常用的化学物质,请写出与N3-互为等电子体的常见粒子的化学式
N2O、CO2、CS2
N2O、CO2、CS2
(写出三种),N3-的空间构型为直线形
直线形
. 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.回答以下问题:
(1)基态氮原子的价电子排布式是
2s22p3
2s22p3
.(2)C、N、O三种元素第一电离能从大到小的顺序是
N>O>C
N>O>C
.(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①NH3分子的空间构型是
三角锥形
三角锥形
;N2H4分子中氮原子轨道的杂化类型是sp3杂化
sp3杂化
.②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1 038.7kJ?mol-1 若该反应中有4mol N-H键断裂,则形成的π键有
3
3
mol.③肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
d
d
(填标号).a.离子键 b.共价键 c.配位键 d.范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.下列分子或离子中,能被该有机化合物识别的是
c
c
(填标号).a.CF4 b.CH4 c.NH
+ 4 |
(2012?奉贤区二模)氮元素可以形成多种化合物.回答以下问题:
(1)氮原子的最外层电子排布式是
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有
(4)肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
a.离子键 b.共价键 c.金属键 d.范德华力.
查看习题详情和答案>>
(1)氮原子的最外层电子排布式是
2s22p3
2s22p3
;氮元素有多种化合价,列举一例含2种氮元素化合价的化合物NH4NO3或NH4NO2
NH4NO3或NH4NO2
(化学式).(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
三角锥型
三角锥型
;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是C2H6
C2H6
(化学式).(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ若该反应中有4mol N-H键断裂,则形成的气体有
3.5
3.5
mol,其中转移电子数目4NA
4NA
.(4)肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
cd
cd
(填标号)a.离子键 b.共价键 c.金属键 d.范德华力.