摘要:原子序数小于36的X.Y.Z.W四种元素.其中X是形成化合物种类最多的元素.Y原子基态时最外层电子数是其内层电子数的2倍.Z原子基态时2p原子轨道上有3个未成对的电子.W的原子序数为29. 回答下列问题: (1)Y2X2分子中Y原子轨道的杂化类型为 .1mol Y2X2含有σ键的数目为 . (2)化合物ZX3的沸点比化合物YX4的高.其主要原因是 . (3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体.元素Z的这种氧化物的分子式是 . (4)元素W的一种氯化物晶体的晶胞结构如图13所示.该氯化物的化学式是 .它可与浓盐酸发生非氧化还原反应.生成配合物HnWCl3.反应的化学方程式为 . 解析:本题把元素推理和物质结构与性质熔融合成一体.考查学生对元素推理.原子轨道杂化类型.分子空间结构.氢键.等电子体原理.晶胞结构.化学键的数目计算.新情景化学方程式书写等知识的掌握和应用能力.本题基础性较强.重点特出.由题意知X.Y.Z.W四种元素分别是:H.C.N.Cu. [备考提示]的知识点是单一的.基础的.我们一定要确保学生不在这些题目上失分.看来还是要狠抓重要知识点.强化主干知识的巩固和运用. 答案:(1)sp杂化 3mol或3×6.2×10 个 (2)NH3分子存在氢键 (3)N2O (4)CuCl CuCl+2HCl=H2CuCl3 (或CuCl+2HCl=H2[CuCl3])
网址:http://m.1010jiajiao.com/timu3_id_86251[举报]
[物质结构与性质]
原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X元素原子半径是所有元素原子中最小的,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子序数为24.(用元素符号或化学式表示).
(1)Y、Z、W的第一电离能由小到大的顺序为
(2)J原子的核外电子排布式为
(3)Y2X2分子中Y原子轨道的杂化类型为
(4)Z与W形成的一种Z2W分子,与该分子互为等电子体的阴离子为
(5)JCl3能与Z、W的氢化物形成配位数为6的络合物,且相应两种配体的物质的量之比为2:1,氯离子全部位于外界.则该配合物的化学式为
查看习题详情和答案>>
原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X元素原子半径是所有元素原子中最小的,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子序数为24.(用元素符号或化学式表示).
(1)Y、Z、W的第一电离能由小到大的顺序为
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
.(2)J原子的核外电子排布式为
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
.(3)Y2X2分子中Y原子轨道的杂化类型为
sp
sp
.1mol Y2X2分子中含有σ键与π键的数目之比为3:2
3:2
.(4)Z与W形成的一种Z2W分子,与该分子互为等电子体的阴离子为
N3-
N3-
(任写一种).(5)JCl3能与Z、W的氢化物形成配位数为6的络合物,且相应两种配体的物质的量之比为2:1,氯离子全部位于外界.则该配合物的化学式为
[Cr(NH3)4(H2O)2]Cl3
[Cr(NH3)4(H2O)2]Cl3
. (2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
(2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为
sp杂化
sp杂化
,1mol Y2X2含有σ键的数目为3mol或3×6.02×1023个
3mol或3×6.02×1023个
.(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是
NH3分子存在氢键
NH3分子存在氢键
.(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是
N2O
N2O
.(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是
CuCl
CuCl
,它可与浓盐酸发生非氧化还原反应,生成配合物H2WCl3,反应的化学方程式为CuCl+2HCl═H2CuCl3(或CuCl+2HCl═H2[CuCl3]
CuCl+2HCl═H2CuCl3(或CuCl+2HCl═H2[CuCl3]
.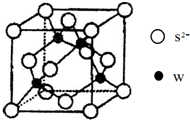 原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.
原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.(1)元素W的电子排布式为
(2)X、Y与氢元素形成的化合物XH2-YH中采用sp3杂化的原子有
(3)ZO4-离子的空间构型为
(4)元素W的一种硫化物晶体的晶胞结构如右上图所示,该硫化物的化学式是
 原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:
原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:(1)X、Y、Z的电负性由小到大的顺序是
Si<C<O
Si<C<O
.(2)N3一与x、Y形成的一种化合物互为等电子体,则N3一的空
间构型为
直线型
直线型
、电子式为

(3)同为原子晶体的XY2与ZY2中硬度小的是
SiO2
SiO2
.(4)X和W所形成的某种晶体结构如图所示,写出:
①基态W2+离子的价电子排布式
3d6
3d6
;②该晶体的化学式
FeC
FeC
.原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为 。

查看习题详情和答案>>