摘要:5.已知:①CO(g)+O2(g)===CO2(g),ΔH=-283.0 kJ·mol-1 ②H2(g)+O2(g)===H2O(g),ΔH=-241.8 kJ·mol-1 下列说法正确的是( ) A.通常状况下.氢气的燃烧热为241.8 kJ·mol-1 B.由①可知.1 mol CO(g)和mol O2(g)反应生成1 mol CO2(g).放出283.0 kJ的热量 C.可用上图表示2CO2+O2(g)反应过程中的能量变化关系 D.分解1 mol H2O(g).其反应热为-241.8 kJ 解析:选项A.热化学方程式②中.H2O(g)不是稳定态.所以241.8 kJ·mol-1不是H2的燃烧热.选项B.根据热化学方程式的含义可知正确.选项C.忽视化学计量数与反应热的关系.错误.选项D.分解1 mol H2O(g)吸收241.8 kJ热量.其反应热为+241.8 kJ/mol. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_85288[举报]
(2010?丰台区二模)汽车尾气中含有CO和氮氧化物.治理尾气的方法是在排气管上安一个催化转化器,其中发生如下反应:2NO+2CO?N2+2CO2.
(1)2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数的表达式为:K=
.
(2)已知:CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
(3)对于可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2 和CO2的方向移动
(4)下列说法正确的是
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24L CO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为
查看习题详情和答案>>
(1)2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数的表达式为:K=
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
| [CO2]2?[N2] |
| [NO]2?[CO]2 |
(2)已知:CO(g)+1/2O2(g)=2CO2(g)△H=-283kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
-746
-746
kJ/mol.(3)对于可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是
③④
③④
.①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2 和CO2的方向移动
(4)下列说法正确的是
②③
②③
.①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气,在高温条件下生成的
(5)实验室可以利用NaOH溶液吸收CO2,标准状况下2.24L CO2气体被1.5L 0.1mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成Na2CO3的物质的量为
0.05
0.05
mol. 2CO(g)+O2(g)?2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:
2CO(g)+O2(g)?2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:(1)图中A点表示:
(2)图中△H=
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.
已知:①CO(g)+
O2(g)=CO2(g)△H=-283.0KJ?mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ?mol-1
此反应的热化学方程式是
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体.已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a KJ?mol-1(a>0)
②2CO(g)+2NO (g)=N2(g)+2CO2(g)△H=-b KJ?mol-1(b>0)
若用标准状况下 3.36L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ?mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,则△H2=
查看习题详情和答案>>
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.
已知:①CO(g)+
| 1 | 2 |
②S(s)+O2(g)=SO2(g)△H=-296.0KJ?mol-1
此反应的热化学方程式是
2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=-270KJ?mol-1
2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=-270KJ?mol-1
.(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体.已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a KJ?mol-1(a>0)
②2CO(g)+2NO (g)=N2(g)+2CO2(g)△H=-b KJ?mol-1(b>0)
若用标准状况下 3.36L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
0.3
0.3
mol,放出的热量为3(2a+b)/80
3(2a+b)/80
KJ(用含有a和b的代数式表示).(3)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ?mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,则△H2=
-1160KJ/mol
-1160KJ/mol
.已知:CO(g)+1/2O2(g)=CO2(g)△H=-283kJ/mol;N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
30g一氧化氮反应生成氮气和二氧化碳
查看习题详情和答案>>
则反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=
-746
-746
kJ/mol.30g一氧化氮反应生成氮气和二氧化碳
放出
放出
(填吸收或放出)热量373
373
kJ.乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ?mol-1
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1
(1)以C O2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H= .
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
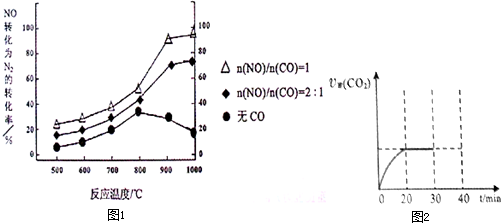
①某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右.
②用活性炭还原法处理氮氧化物.有关反应为:C (s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭容器中加入足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
I.根据表中数据,求反应开始至20min以υ(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字).
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .图2示CO2的逆反应速率[υ逆(CO2)]随反应时间的变化关系图.请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线.
查看习题详情和答案>>
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ?mol-1
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1

(1)以C O2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
①某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为
②用活性炭还原法处理氮氧化物.有关反应为:C (s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭容器中加入足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是