摘要:13.用如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后.塞紧橡皮塞.立即打开止水夹.Ⅱ中有气泡冒出,一段时间后关闭止水夹.Ⅱ中液面上升.溶液由澄清变浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( ) A B C D Ⅰ CaCO3.稀盐酸 Na2CO3.稀硫酸 Zn.稀盐酸 Cu.稀硫酸 Ⅱ Ca(OH)2 NaCl AgNO3 Ba(OH)2 解析:采用淘汰法.A选项要仔细分辨.开始时Ⅱ中溶液会先变浑浊.当关闭止水夹后.由于气体压强的缘故.Ⅰ中的溶液被压入Ⅱ中.由于盐酸的作用.Ⅱ中溶液应该由浑浊变澄清.不符合题意,B选项Ⅱ中有气泡产生.但其溶液不会变浑浊,C选项产生H2.关闭止水夹后.由于气体压强的缘故.将Ⅰ中的溶液压入Ⅱ中.会反应生成AgCl难溶物.使溶液变浑浊.D选项中Cu和稀硫酸不能反应. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_85043[举报]
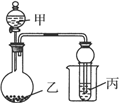 用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 饱和食盐水 | 电石 | 酸性 KMnO4溶液 | 紫色褪去 | 乙炔可发生氧化反应 |
| B | 稀硫酸 | 亚硫酸钠 | 溴水 | 橙色褪去 | SO2具有漂白性 |
| C | 醋酸 | 碳酸钠 | BaCl2溶液 | 变浑浊 | 醋酸酸性强于碳酸 |
| D | 浓氨水 | 生石灰 | AgNO3溶液 | 无明显现象 | NH3与 AgNO3溶液不反应 |
 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:(1)图中D装置在实验中的作用是
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开F后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开F后,C中的现象是
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开F,足够长的时间后,C中的现象是
 用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中(可加热),试管中试剂为丙,则下表中对应选项错误的是( )
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中(可加热),试管中试剂为丙,则下表中对应选项错误的是( )| 甲 | 乙 | 丙 | 试管中的现象 | |
| A | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| B | 醋酸 | 石灰石 | Ca(OH)2溶液 | 先沉淀后消失 |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | 先沉淀后消失 |
| D | 稀硝酸 | 铜 | 水 | 试管口出现红棕色 |
| A、A | B、B | C、C | D、D |
下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用如图所示装置进行实验.

①A装置的作用是 (填“干燥”或“氧化”)SO2气体.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸.
③D装置的作用是 .D中发生反应的化学方程式是 .
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定.说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4.
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为 (填“催化剂’’或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因.
查看习题详情和答案>>
| 污染指数 | 首要污染物 | 空气质量等级 | 空气质量状况 |
| 55 | SO2 | Ⅱ | 良 |
(1)用如图所示装置进行实验.

①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
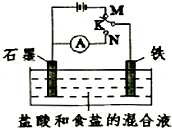 (2013?日照二模)用如图所示装置进行实验,下列叙述不正确的是( )
(2013?日照二模)用如图所示装置进行实验,下列叙述不正确的是( )