摘要:11.A.B.C.D.E均为中学化学中的常见单质或化合物.它们之间的反应关系如图所示: (1)若A是短周期中原子半径最大的元素构成的单质.E既可溶于盐酸又可溶于NaOH溶液.E溶于NaOH溶液的离子方程式是 ,工业上冶炼A的化学反应方程式是 . (2)若C是既含有极性键又含有非极性键的四原子分子.则实验室制取C的化学方程式是 ,1 mol C完全燃烧生成液态水时放出1 300 kJ的热量.则C完全燃烧的热化学方程式是 .A与B的溶液反应时只生成气体C.碳酸钙沉淀和水.则B的化学式是 . 解析:(1)根据“若A是短周期中原子半径最大的元素构成的单质 可知A为Na.根据“E既可溶于盐酸又可溶于NaOH溶液 可知E为Al(OH)3.B溶液为含有Al3+的盐溶液.气体C为H2.D为钠盐.工业上通过电解熔融NaCl来冶炼金属钠. (2)根据“C是既含有极性键又含有非极性键的四原子分子 可推知C为C2H2.固体A为CaC2.CaC2与H2O反应生成C2H2:CaC2+2H2O―→C2H2↑+Ca(OH)2.根据热化学方程式的书写原则.可写出C2H2完全燃烧的热化学方程式.CaC2与Ca(HCO3)2溶液反应生成C2H2.CaCO3和H2O. 答案:3+OH-===AlO+2H2O 2NaCl电解2Na+Cl2↑ (2)CaC2+2H2O―→C2H2↑+Ca(OH)2 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l),ΔH=-2 600 kJ·mol-1 Ca(HCO3)2
网址:http://m.1010jiajiao.com/timu3_id_84683[举报]
甲、乙、丙、丁为四种单质,其中两种为气体,且一种为黄绿色气体,A、B、C、D、E均为化合物,E常温下为无色液体,它们之间的转化关系如图所示:

请回答下列问题
(1)写出下列物质的化学式:丁
(2)检验C溶液中所含阳离子的试剂是:
(3)丙与A溶液反应的离子方程式:
(4)C溶液与丁反应生成D的化学方程式:
查看习题详情和答案>>

请回答下列问题
(1)写出下列物质的化学式:丁
Fe
Fe
,DFeCl2
FeCl2
;(2)检验C溶液中所含阳离子的试剂是:
KSCN溶液
KSCN溶液
,现象:溶液出现血红色
溶液出现血红色
;(3)丙与A溶液反应的离子方程式:
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
;(4)C溶液与丁反应生成D的化学方程式:
Fe+2FeCl3═3FeCl2
Fe+2FeCl3═3FeCl2
.A、B、C、D、E均为可溶于水的固体,组成它们的离子有
分别取它们的水溶液进行实验.结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失.据此推断它们是
A
查看习题详情和答案>>
| 阳离子 | Na+、Mg2+、Al3+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、SO42-、HSO4- |
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失.据此推断它们是
A
Na2CO3
Na2CO3
;BAl2(SO4)3
Al2(SO4)3
;CMgCl2
MgCl2
;DBa(OH)2
Ba(OH)2
. 如图是元素周期表的一部分,已知A、B、C、D、E均为短周期元素,D元素最外层电子数为最内层电子数的3倍,下列说法中正确的是( )
如图是元素周期表的一部分,已知A、B、C、D、E均为短周期元素,D元素最外层电子数为最内层电子数的3倍,下列说法中正确的是( )| A、元素A位于第二周期第ⅣA族 | B、原子半径:B>C | C、最高价氧化物对应水化物的酸性:C>E | D、气态氢化物的稳定性:D>B |
 己知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
己知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色固体,则B的化学式为
O2
O2
,A与E在一定条件下反应生成D的化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为酸,且C的组成中含有与A相同的元素.则构成非金属单质A的元素原子结构示意图为


HCl
HCl
,A与E在一定条件下反应生成D的离子方程式为2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.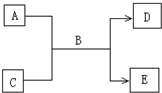 (2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则:该反应的反应方程式为
Cl2+SO2+2H2O=H2SO4+2HCl
Cl2+SO2+2H2O=H2SO4+2HCl
,检验D中阴离子的方法是先加硝酸酸化无沉淀,再滴加AgNO3溶液有白色沉淀生成,则含Cl-
先加硝酸酸化无沉淀,再滴加AgNO3溶液有白色沉淀生成,则含Cl-
.(2)若A为短周期的金属单质,D为气态单质,C溶液呈强酸性或强碱性时,该反应都能进行.写出反应的离子方程式
2Al+6H+=2Al3++3H2↑
2Al+6H+=2Al3++3H2↑
;2Al+2OH-+H2O=2AlO-+H2↑
2Al+2OH-+H2O=2AlO-+H2↑
.(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的化学式(写两种)
H2SiO3
H2SiO3
、Al ( OH )3
Al ( OH )3
写出生成E的一个离子方程式SiO32-+CO2+H2O=CO32-+H2SiO3↓或 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
SiO32-+CO2+H2O=CO32-+H2SiO3↓或 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
.或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-