摘要:28.答案解析:抓住反应①.③是工业生产中的重要反应这个突破口.再结合A是固体.得出:反应①是煅烧FeS2制SO2.X是无色液体.应为水.③是制SO3.②是固体B与水作用产生O2.则固体B为过氧化钠.其他就好解了.参考答案归纳如下: (1) 2Na2O2+2H2O===4NaOH+O2↑ (1)离子键.非极性键 (2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓+3Na2SO4 (3)FeS2(s) + 11/4 O2(g) = 1/2 Fe2O3(s)+ 2SO2(g),△H=-852kJ/mol 应试策略:有一类框图推断题.考查中学所学的工业生产原理.并结合元素化合物的知识.综合考查工业生产中常见化合物的性质.有一定的综合性.题目有一定难度.除有扎实的基本功外.还要有一定灵活运用知识的能力.较强的推理能力.
网址:http://m.1010jiajiao.com/timu3_id_84173[举报]
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是
A.2:3 B.3:2 C.4:3 D.1:3
【解析】根据反应前后的元素的化合价变化可判断,N元素由-3价升高到0,即氮气是氧化产物,每生成1mol氮气转移6mol电子。Pt的化合价由+4价降低到0价,所以Pt是还原产物。根据得失电子守恒可知生成铂的物质的量是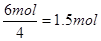 ,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
,所以氧化产物和还原产物的物质的量之比是2:3,选项A正确。答案选A。
查看习题详情和答案>>
已知448℃时反应H2(g)+I2(g) 2HI(g)的平衡常数是49,则
2HI(g)的平衡常数是49,则 ,在该温度下的平衡常数是
,在该温度下的平衡常数是
A. B.2401 C.7
D.
B.2401 C.7
D.
【解析】逆反应的平衡常数是正反应的倒数,H2(g)+I2(g) 2HI(g)的平衡常数是49,则1/2H2(g)+1/2I2(g)
2HI(g)的平衡常数是49,则1/2H2(g)+1/2I2(g) HI(g)的平衡常数是7,所以反应
HI(g)的平衡常数是7,所以反应 的平衡常数是1.7,答案是D。
的平衡常数是1.7,答案是D。
查看习题详情和答案>>
为了制取碘,可通过反应:2NO+O2==2NO2 NO2+2H+ +2I- ==NO + I2+H2O制得,NO在制碘过程中的作用是
A.还原剂 B.氧化剂 C.催化剂 D.反应物
【解析】根据反应观察可知反应前后NO的的量并没有发生变化,但参与了化学反应,所以起催化剂作用,答案是C。
查看习题详情和答案>>