摘要:答案:D 解析:根据图象知.H2A溶液稀释100倍.溶液PH由2增至4.说明H2A是强酸.而H2B溶液稀释200倍.溶液PH增加2个单位.说明H2B为弱酸.A选项.H2A是强电解质.完全电离.电离方程式为H2A 2H++A2-.A选项错误,B选项.HA- H++A2-.溶液中不存在H2A.HA-.B选项错误,C选项.NaHA和NaHB的物质的量浓度不一定相等.所以.离子浓度关系不确定.C选项错误,D选项.H2B是弱酸.其钠盐水溶液呈碱性.D选项正确.
网址:http://m.1010jiajiao.com/timu3_id_84139[举报]
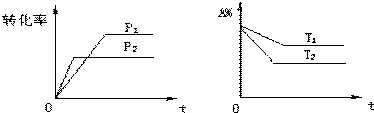
可逆反应aA(g)+bB(g) ![]() cC(g)+dD(g),根据图象判断,下列叙述正确的是
cC(g)+dD(g),根据图象判断,下列叙述正确的是

A、p1<p2,a+b<c+d,T1<T2, 正向吸热 B、p1<p2,a+b>c+d,T1>T2, 正向吸热
C. p1<p2,a+b<c+d,T1>T2, 正向吸热 D. 以上答案均不对
 已知H2B为二元弱酸,请回答下列问题:
已知H2B为二元弱酸,请回答下列问题:(1)①Na2B溶液呈
碱性
碱性
(填酸性”、碱性”或中性”)②若升高Na2B溶液的温度,则c(HB-)和c(B2-)比值将
增大
增大
(填增大”、减小”或不变”)(2)某温度下,在0.1mol/L的NaHB溶液中,以下关系一定不正确的是
C
C
.A.C(H+)?C(OH-)=1×10-14
B.pH>7
C.C(OH-)=2C(H2B)+C(HB-)+C(H+)
D.C(HB-)<0.1mol/L
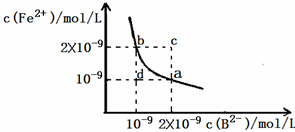
(3)某温度下,FeB在水中的沉淀溶解平衡曲线如图所示.
①写出FeB在水中的沉淀溶解平衡的方程式:
FeB(s)
Fe2+(aq)+B2-(aq)
| 溶解 |
FeB(s)
Fe2+(aq)+B2-(aq)
.| 溶解 |
②该温度下,将FeB固体加入水中,得到的悬浊液中c(Fe2+)为:
1.4×10-9
1.4×10-9
mol/L(保留小数点后1位).③根据图象,下列说法正确的是:
AC
AC
.A.a 点对应的Ksp等于b点对应的Ksp
B.通过蒸发可以使溶液由c点变到a点
C.d 点无FeB沉淀生成
D.若改变条件,使FeB的溶解度发生变化,则FeB的Ksp也一定会发生变化.
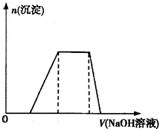 已知某工业废水中含有N
已知某工业废水中含有N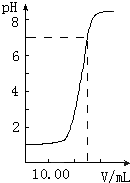 如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )