题目内容
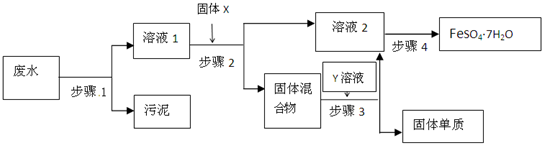
 已知某工业废水中含有N
已知某工业废水中含有N| O | - 3 |
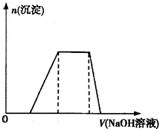
分析:A、若溶液中存在Al3+、NH4+?、H+,滴入氢氧化钠溶液先和氢离子反应,再沉淀铝离子,再和铵根离子反应,最后溶解氢氧化铝沉淀;
B、若溶液中存在Fe3+、NH4+?、H+,滴入氢氧化钠溶液先和氢离子反应,再沉淀铁离子,再和铵根离子反应,最后不能溶解氢氧化铁沉淀;
C、Fe3+、NO3-、H+,最后加入过量的氢氧化钠溶液,沉淀不会溶解;
D、Ag+、NH4+、H+,先产生白色沉淀(这个马上变为棕色),AgNO3+NH3.H2O=AgOH+NH4NO3,继续滴加氨水,沉淀消失,AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O (银氨溶液),图象中不会出现加入氢氧化钠溶液沉淀量不变情况.
B、若溶液中存在Fe3+、NH4+?、H+,滴入氢氧化钠溶液先和氢离子反应,再沉淀铁离子,再和铵根离子反应,最后不能溶解氢氧化铁沉淀;
C、Fe3+、NO3-、H+,最后加入过量的氢氧化钠溶液,沉淀不会溶解;
D、Ag+、NH4+、H+,先产生白色沉淀(这个马上变为棕色),AgNO3+NH3.H2O=AgOH+NH4NO3,继续滴加氨水,沉淀消失,AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O (银氨溶液),图象中不会出现加入氢氧化钠溶液沉淀量不变情况.
解答:解:A、如果溶液中存在Al3+、NH4+?、H+,滴入氢氧化钠溶液先和氢离子反应,再沉淀铝离子,再和铵根离子反应,最后溶解氢氧化铝沉淀,能够与图象一致,故A正确;
B、如果溶液中存在Fe3+、NH4+、H+,滴入氢氧化钠溶液先与氢离子反应,再沉淀铁离子,再和铵根离子反应,但是最后不能溶解氢氧化铁沉淀,故B错误;
C、如果是Fe3+、NO3-、H+,最后加入过量的氢氧化钠溶液,生成的氢氧化铁沉淀不会溶解,故C错误;
D、如果是Ag+、NH4+、H+,先产生白色沉淀(这个马上变为棕色),AgNO3+NH3.H2O=AgOH+NH4NO3,继续滴加氨水,沉淀消失,AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O (银氨溶液),图象中不会出现加入氢氧化钠溶液沉淀量不变情况,故D错误;
故选A.
B、如果溶液中存在Fe3+、NH4+、H+,滴入氢氧化钠溶液先与氢离子反应,再沉淀铁离子,再和铵根离子反应,但是最后不能溶解氢氧化铁沉淀,故B错误;
C、如果是Fe3+、NO3-、H+,最后加入过量的氢氧化钠溶液,生成的氢氧化铁沉淀不会溶解,故C错误;
D、如果是Ag+、NH4+、H+,先产生白色沉淀(这个马上变为棕色),AgNO3+NH3.H2O=AgOH+NH4NO3,继续滴加氨水,沉淀消失,AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O (银氨溶液),图象中不会出现加入氢氧化钠溶液沉淀量不变情况,故D错误;
故选A.
点评:本题是一道关于离子反应和离子检验知识的题目,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目