摘要:2.电化学部分 [备考策略] (1)历年高考都既重视对电解原理及其应用的考查.又重视对新型电源的考查.试题涉及电极名称的判断.电极反应式的书写.自由电子在外电路中定向移动的方向.自由移动离子在电解质中定向移动的方向.电流方向.氧化反应和还原反应的判断.能量转化.简单计算等. (2)电解原理在全国I卷几乎年年考.09年更是在第II卷中以大题的形式进行考查.这一方面说明电解原理及其应用的重要性.在复习过程中应该加强.另一方面也可能预示对电解知识的的大型考查暂告一段落,新型电源.可充电电池的考查有可能在全国I卷中得到重视,重视活泼阳极电解池的考查. (3)帮助学生归纳总结金属空气电池的原理.二次电池(铅蓄电池.锂电池等)的原理.燃料电池的原理.电池污染及回收.金属的腐蚀及防护等知识. (4)熟练掌握5种电解池.惰性电极电解下列溶液.写出下列电极反应式和电解的总化学方程式:①氯化钠溶液.溴化镁溶液 ②硝酸银溶液.硫酸铜溶液 ③氯化铜溶液.盐酸 ④硫酸钠溶液.稀硫酸 (5)电解原理的应用:离子交换膜电解精制饱和食盐水.精炼铜和电镀.电解法冶炼金属.运用电解原理测相对原子质量等. 创新试题预测6:重视活泼阳极电解池
网址:http://m.1010jiajiao.com/timu3_id_84073[举报]
 电化学净水装置是生活用水和工业废水净化处理装置,由预处理、电化学反应、消毒过滤、电动自控四个部分构成.有一种电化学净水原理为在电解过程中将低价态的金属离子(如Co2+)氧化成高价态的金属离子(Co3+),然后以高价态的金属离子作氧化剂把废水中的有机物氧化成CO2,从而达到净化的目的.实验室用如图所示装置模拟上述过程,下列说法错误的是( )
电化学净水装置是生活用水和工业废水净化处理装置,由预处理、电化学反应、消毒过滤、电动自控四个部分构成.有一种电化学净水原理为在电解过程中将低价态的金属离子(如Co2+)氧化成高价态的金属离子(Co3+),然后以高价态的金属离子作氧化剂把废水中的有机物氧化成CO2,从而达到净化的目的.实验室用如图所示装置模拟上述过程,下列说法错误的是( )
查看习题详情和答案>>
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
水煤气变换反应:
(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2 (g)△H3=-41.1kJ?mol-1
二甲醚合成反应:
(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一.工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是
Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4,NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3,2Al(OH)3
Al2O3+3H2O
| ||
Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4,NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3,2Al(OH)3
Al2O3+3H2O
(以化学方程式表示).
| ||
(2)分析二甲醚合成反应(Ⅳ)对于CO转化率的影响
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
.(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
.根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
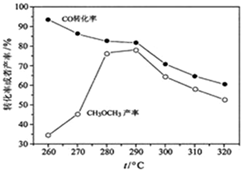
.(4)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示.其中CO转化率随温度升高而降低的原因是
反应放热,温度升高,平衡左移
反应放热,温度升高,平衡左移
.(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW?h?kg-1).若电解质为酸性,二甲醚直接燃料电池的负极反应为
CH3OCH3+3H2O=2CO2+12H++12e-
CH3OCH3+3H2O=2CO2+12H++12e-
,一个二甲醚分子经过电化学氧化,可以产生12
12
个电子的能量;该电池的理论输出电压为1.20V,能量密度E=1.2V×
| ||
|
1.2V×
| ||
|
A-J是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知A是由两种元素组成的化合物,D是一种红棕色固体,H的焰色反应呈黄色.

请回答下列问题:
(1)B物质的化学式为
(2)G→J的化学方程式为
(3)D物质与盐酸反应所得溶液显酸性的原因是(用离子方程式表示):
(4)E与碳形成的合金在潮湿的空气中易发生电化学腐蚀,其正极的电极反应式为:
(5)写出一个满足下列两个条件的置换反应方程式:
①在A--J中选一种单质作为反应物;
②生成物之一是具有磁性的氧化物.
查看习题详情和答案>>

请回答下列问题:
(1)B物质的化学式为
O2
O2
,H物质的名称为偏铝酸钠
偏铝酸钠
.(2)G→J的化学方程式为
4Fe(OH)2+2H2O+O2═4Fe(OH)3
4Fe(OH)2+2H2O+O2═4Fe(OH)3
.(3)D物质与盐酸反应所得溶液显酸性的原因是(用离子方程式表示):
Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
 Fe(OH)3+3H+
Fe(OH)3+3H+Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
. Fe(OH)3+3H+
Fe(OH)3+3H+(4)E与碳形成的合金在潮湿的空气中易发生电化学腐蚀,其正极的电极反应式为:
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
.(5)写出一个满足下列两个条件的置换反应方程式:
3Fe+4H2O(g)
Fe3O4+4H2↑
| ||
3Fe+4H2O(g)
Fe3O4+4H2↑
.
| ||
①在A--J中选一种单质作为反应物;
②生成物之一是具有磁性的氧化物.