网址:http://m.1010jiajiao.com/timu3_id_81582[举报]
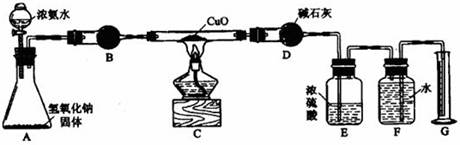
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢氧化钠
(4)E装置中盛装浓硫酸的目的是: ;
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.
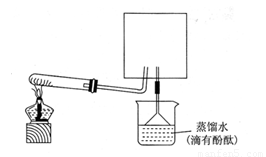
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
查看习题详情和答案>>
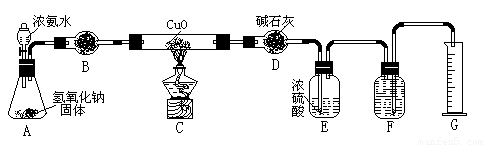
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
A.碱石灰 B.生石灰 C.五氧化二磷 D.氢氧化钠
(4)E装置中盛装浓硫酸的目的是: ;
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
查看习题详情和答案>>
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题: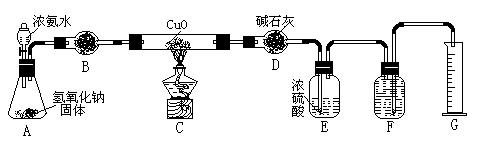
(1)写出氨气与氧化铜反应的化学方程式: 。
(2)在A的锥形瓶中放入NaOH固体的目的是 。
(3)在干燥管B中不能选用的干燥剂是 (填序号);
| A.碱石灰 | B.生石灰 | C.五氧化二磷 | D.氢氧化钠 |
(
 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。(6)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集NH3
①在图中方框内画出用烧瓶收集甲的仪器装置简图.
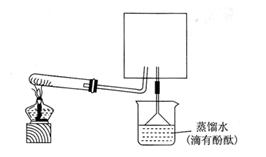
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
 。
查看习题详情和答案>>
。
查看习题详情和答案>>