摘要: 有两种实验操作:①向1L1mol/L的Na2CO3溶液中逐滴加入200mL 61mol/L盐酸,②向200mL 61mol/L的盐酸中逐滴加入1L 11mol/L的Na2CO3溶液.在相同情况下产生气体的体积( ) A. 相同 B. 前者多 C. 后者多 D. 无法判断
网址:http://m.1010jiajiao.com/timu3_id_80228[举报]
(2013?安徽模拟)亚硝酸盐是一祌常见的食品添加剂,使用时必须严格控制其用量.为检测某食品中亚硝 酸盐含量(通常以1kg样品中含NaN02的质量计),某研究小组设计了如下两种实验方案: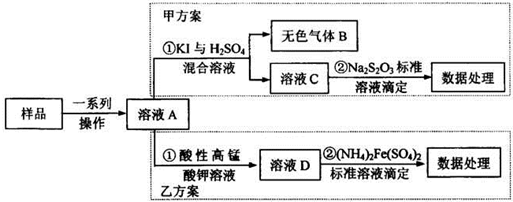
(1)无色气体B遇空气显红棕色,B的化学式为
(2)完成并配平乙方案①中反应的离子方程式
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾 溶液(过童)与溶液A反应.反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色 溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液1O.OOmL.则1kg样品中 NaNO2的质量为
mg.
查看习题详情和答案>>

(1)无色气体B遇空气显红棕色,B的化学式为
NO
NO
写出甲方案①中反应的离子方程式2I-+2NO2-+4H+=I2+2NO↑+2H2O
2I-+2NO2-+4H+=I2+2NO↑+2H2O
(2)完成并配平乙方案①中反应的离子方程式
2
2
MnO4-+5
5
NO2+6
6
=2
2
Mn 2++5
5
NO3-+3
3
(3)乙方案②中需配置100mL0.0010mol/L(NH4)2Fe(SO4)2标准溶液,在已准确称量样品的质量后,还需要的仪器有:量筒、烧杯、
玻璃棒、100mL容量瓶、胶头滴管
玻璃棒、100mL容量瓶、胶头滴管
配制溶液时,定容的操作方法是向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切.
向容量瓶中注入蒸馏水,当液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切.
(4)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性高锰酸钾 溶液(过童)与溶液A反应.反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色 溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液1O.OOmL.则1kg样品中 NaNO2的质量为
| 690 |
| a |
| 690 |
| a |
(2012?安徽)亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
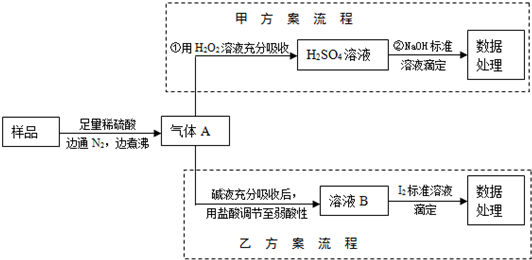
(1)气体A的主要成分是
(2)写出甲方案第①步反应的离子方程式:
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果
(5)若取样品wg,按乙方案测得消耗0.01000mol?L-1I2溶液VmL,则1kg样品中含SO2的质量是
g(用含w、V的代数式表示).
查看习题详情和答案>>

(1)气体A的主要成分是
SO2
SO2
,为防止煮沸时发生暴沸,必须先向烧瓶中加入碎瓷片
碎瓷片
;通入N2的目的是将生成的SO2全部赶出(防止SO2在水溶液中被O2氧化)
将生成的SO2全部赶出(防止SO2在水溶液中被O2氧化)
.(2)写出甲方案第①步反应的离子方程式:
SO2+H2O2=SO42-+2H+
SO2+H2O2=SO42-+2H+
.(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是
在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次
在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次
.(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果
无影响
无影响
(填“偏高”、“偏低”或“无影响”)(5)若取样品wg,按乙方案测得消耗0.01000mol?L-1I2溶液VmL,则1kg样品中含SO2的质量是
| 0.64V |
| w |
| 0.64V |
| w |
向溴水中加入足量乙醛溶液,可以看到溴水褪色.据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醒发生加成反应;
(3)溴水与乙醛发生 反应.
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性.
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量.
(1)方案1是否可行? ?理由是
(2)假设测得反应前用于溴水制备的Br2的物质的量为a mol,
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生取代反应
若测得反应后n(Br-)= mol,则说明猜测(3)正确.
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙酸溶液使其褪色;再加入过量AgN03溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应).根据计算结果,推知溴水与乙醛反应的离子方程式为 .
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表).
查看习题详情和答案>>
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醒发生加成反应;
(3)溴水与乙醛发生
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性.
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量.
(1)方案1是否可行?
(2)假设测得反应前用于溴水制备的Br2的物质的量为a mol,
若测得反应后n(Br-)=
若测得反应后n(Br-)=
若测得反应后n(Br-)=
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙酸溶液使其褪色;再加入过量AgN03溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应).根据计算结果,推知溴水与乙醛反应的离子方程式为
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表).
| 实验操作步骤 | 实验现象 | 结论 |
向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应(一取代);②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸.为探究哪种猜想正确,两研究性学习小组提出了如下两种实验方案:
(1)试写出上述①,②,③猜想可能发生反应的化学方程式
① ② ③ .
(2)方案一:甲组同学为证实上述猜想的①还是②,设计了一种简单的实验方案,该方案及结论是 .
(3)方案二:乙组同学通过测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量来判断上述反应原理,假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸.
(4)乙组同学按物质的量之比为1:5配制1000mL KBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2.取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g.若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 .
查看习题详情和答案>>
(1)试写出上述①,②,③猜想可能发生反应的化学方程式
①
(2)方案一:甲组同学为证实上述猜想的①还是②,设计了一种简单的实验方案,该方案及结论是
(3)方案二:乙组同学通过测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量来判断上述反应原理,假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=
若测得反应后n(Br-)=
若测得反应后n(Br-)=
(4)乙组同学按物质的量之比为1:5配制1000mL KBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2.取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g.若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为
(15分)亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常1kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
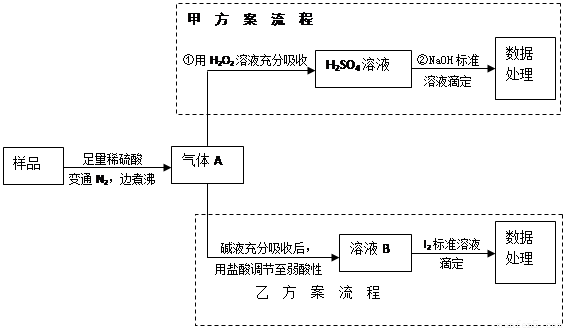
(1)气体A的主要成分是 ,为防止煮沸时发生暴沸,必须先向烧瓶中加入
;通入N2的目的是 。
(2)写出甲方案第①步反应的离子方程式: 。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是
。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果 (填“偏高”、“偏低”或“无影响”)
(5)若取样品wg,按乙方案测得消耗0.01000mol·L—1I2溶液VmL,则1kg样品中含SO2的质量是 g(用含w、V的代数式表示)。
查看习题详情和答案>>