题目内容
向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应(一取代);②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸.为探究哪种猜想正确,两研究性学习小组提出了如下两种实验方案:
(1)试写出上述①,②,③猜想可能发生反应的化学方程式
① ② ③ .
(2)方案一:甲组同学为证实上述猜想的①还是②,设计了一种简单的实验方案,该方案及结论是 .
(3)方案二:乙组同学通过测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量来判断上述反应原理,假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)= mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸.
(4)乙组同学按物质的量之比为1:5配制1000mL KBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2.取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g.若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 .
(1)试写出上述①,②,③猜想可能发生反应的化学方程式
①
(2)方案一:甲组同学为证实上述猜想的①还是②,设计了一种简单的实验方案,该方案及结论是
(3)方案二:乙组同学通过测定反应前溴水中Br2的物质的量和反应后溶液中Br-离子的物质的量来判断上述反应原理,假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=
若测得反应后n(Br-)=
若测得反应后n(Br-)=
(4)乙组同学按物质的量之比为1:5配制1000mL KBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2.取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g.若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为
分析:(1)①溴水中的溴与乙醛发生取代反应生成CH2BrCHO;
②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应生成CH3CBr2O;
③由于乙醛具有还原性,溴水将乙醛氧化为乙酸;
(2)溴水与乙醛发生取代反应生成溴化氢,溶液为酸性;溴水与乙醛发生加成反应,无溴化氢,溶液为中性;
(3)由于发生三种反应后溶液中Br-的量存在差异,且由于乙醛是足量的,溴水中的溴全部参与反应,取代反应中生成n(Br-)=a mol,加成反应中n(Br-)=0 mol,氧反应中n(Br-)=2amol;
(4)加入过量AgN03溶液,得到淡黄色沉淀为AgBr,根据质量求出其物质的量,再分析反应.
②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应生成CH3CBr2O;
③由于乙醛具有还原性,溴水将乙醛氧化为乙酸;
(2)溴水与乙醛发生取代反应生成溴化氢,溶液为酸性;溴水与乙醛发生加成反应,无溴化氢,溶液为中性;
(3)由于发生三种反应后溶液中Br-的量存在差异,且由于乙醛是足量的,溴水中的溴全部参与反应,取代反应中生成n(Br-)=a mol,加成反应中n(Br-)=0 mol,氧反应中n(Br-)=2amol;
(4)加入过量AgN03溶液,得到淡黄色沉淀为AgBr,根据质量求出其物质的量,再分析反应.
解答:解:(1)①溴水中的溴与乙醛发生取代反应生成CH3CBrO,方程式为:Br2+CH3CHO→HBr+CH3CBrO;
故答案为:Br2+CH3CHO→HBr+CH3CBrO;
②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应生成CH3CBr2O,方程式为:CH3CHO+Br2→CH3CBr2O,
故答案为:CH3CHO+Br2→CH3CBr2O;
③由于乙醛具有还原性,溴水将乙醛氧化为乙酸,方程式为:CH3CHO+Br2+H2O=CH3COOH+2HBr;
故答案为:CH3CHO+Br2+H2O=CH3COOH+2HBr;
(2)溴水与乙醛发生取代反应生成溴化氢,溶液为酸性,而溴水与乙醛发生加成反应,无溴化氢,溶液为中性,所以检验褪色后溶液的酸碱性,若为酸性,则证实上述猜想的①,否则为②;
故答案为:检验褪色后溶液的酸碱性,若为酸性,则证实上述猜想的①,否则为②;
(3)如发生取代反应,则amolBr2取代amolH,溶液中应有amolBr-;如果发生加成反应,则溶液中不存在Br-;如发生氧化反应,存在CH3CHO+Br2+H2O=CH3COOH+2H++2Br-,溶液中存在2amolBr-,
故答案为:a;0;2a;
(4)准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g,则原溶液会得到固体0.188g×10×100=188g,n(AgBr)=
=1mol,n(Br-)=2n(Br2),则反应应为氧化反应,其离子方程式为:CH3CHO+Br2+H2O=CH3COOH+2H++2Br-,该反应时氧化反应;
故答案为:氧化反应.
故答案为:Br2+CH3CHO→HBr+CH3CBrO;
②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应生成CH3CBr2O,方程式为:CH3CHO+Br2→CH3CBr2O,
故答案为:CH3CHO+Br2→CH3CBr2O;
③由于乙醛具有还原性,溴水将乙醛氧化为乙酸,方程式为:CH3CHO+Br2+H2O=CH3COOH+2HBr;
故答案为:CH3CHO+Br2+H2O=CH3COOH+2HBr;
(2)溴水与乙醛发生取代反应生成溴化氢,溶液为酸性,而溴水与乙醛发生加成反应,无溴化氢,溶液为中性,所以检验褪色后溶液的酸碱性,若为酸性,则证实上述猜想的①,否则为②;
故答案为:检验褪色后溶液的酸碱性,若为酸性,则证实上述猜想的①,否则为②;
(3)如发生取代反应,则amolBr2取代amolH,溶液中应有amolBr-;如果发生加成反应,则溶液中不存在Br-;如发生氧化反应,存在CH3CHO+Br2+H2O=CH3COOH+2H++2Br-,溶液中存在2amolBr-,
故答案为:a;0;2a;
(4)准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g,则原溶液会得到固体0.188g×10×100=188g,n(AgBr)=
| 188g |
| 188g/mol |
故答案为:氧化反应.
点评:本题考查化学反应机理的探讨,题目难度中等,本题注意把握方程式的书写以及计算时溶液的体积为解答该题的关键.

练习册系列答案
相关题目
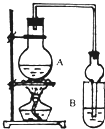 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)A中浓硫酸的作用是
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
(4)反应结束后D中的现象是
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰.