网址:http://m.1010jiajiao.com/timu3_id_77244[举报]
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。
已知:A(s)+B(g)===C(g)+D(g) ΔH=+131.4 kJ·mol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
(1)写出A元素的名称________。
(2)另外知:
A(s)+O2(g)===G(g) ΔH=-393.6 kJ·mol-1
C(g)+![]() O2(g)===G(g) ΔH=-283 kJ·mol-1
O2(g)===G(g) ΔH=-283 kJ·mol-1
D(g)+![]() O2(g)===B(g) ΔH=-242 kJ·mol-1
O2(g)===B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?并说明理由_____________________________________________________________________ 。
(3)写出A + O2 = C的热化学方程式: 。

A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。
已知:A(s)+B(g)===C(g)+D(g) ΔH=+131.4 kJ·mol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
(1)写出A元素的名称________。
(2)另外知:
A(s)+O2(g)===G(g) ΔH=-393.6 kJ·mol-1
C(g)+![]() O2(g)===G(g) ΔH=-283 kJ·mol-1
O2(g)===G(g) ΔH=-283 kJ·mol-1
D(g)+![]() O2(g)===B(g) ΔH=-242 kJ·mol-1
O2(g)===B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?并说明理由_______________________________________________。
(3)写出A + O2 = C的热化学方程式: 。

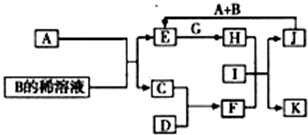 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
(1)工业上冶炼金属A的方法称为______.
(2)向E的溶液中加入氢氧化钠溶液的实验现象为______,反应的化学方程式为______.
(3)写出E的酸性溶液与G反应转化为H的离子方程式______.
(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K______L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明)______.
查看习题详情和答案>>
 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.(1)工业上冶炼金属A的方法称为______.
(2)向E的溶液中加入氢氧化钠溶液的实验现象为______,反应的化学方程式为______.
(3)写出E的酸性溶液与G反应转化为H的离子方程式______.
(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K______L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明)______.
查看习题详情和答案>>
请回答下列问题:
(1)A物质的名称为
(2)C与D在高温下的反应在冶金工业上称为
(3)写出G→J的化学方程式:
(4)C的氮化物是一种良好的耐热冲击材料,可溶解于强碱溶液,写出其反应方程式:
(5)E在潮湿的空气中容易被腐蚀,为了减少腐蚀,可以采用电化学的方法进行防护装置如图乙所示:
当开关K置于M处,E电极材料应为
当开关K置于N处、E为碳棒时,N与电源的
