摘要:12.下列说法正确的是 ( ) A.常温下.NaHCO3溶液中一定存在c(Na+)+c(H+)=c(HCO3-)+c(OH-) B.常温下.某溶液中由水电离出的c(H+)=1×10-12mol/L.则该溶液可能是NH4Cl溶液 C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性 c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) D.0.1mol·L-1的NaHA溶液.其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) 第Ⅱ卷
网址:http://m.1010jiajiao.com/timu3_id_77147[举报]
下列说法正确的是
△H<0,当v(SO2)= v(SO3)时,说明该反应已达到平衡状态
| A.常温下,物质的量浓度均为0.1mol·L?1Na2CO3和NaHCO3的等体积混合溶液中: 2c(OH?)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32?) |
| B.ΔH<0,ΔS>0的反应都是自发反应,ΔH>0,ΔS>0的反应任何条件都是非自发反应; |
| C.已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1 P4(g)+10Cl2(g)=4PCl5(g)ΔH=bkJ·mol-1 P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1,由此计算Cl-Cl键的键能 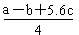 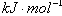 |
D.在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) 2SO3(g) |
下列说法正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液pH值大
B.离子化合物中一定不含有共价键
C.水加热到很高的温度都难以分解是因为水分子间存在氢键
D.同周期元素的原子或离子半径均从左到右逐渐减小
查看习题详情和答案>>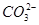 )>c(
)>c(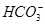 )
)