网址:http://m.1010jiajiao.com/timu3_id_76288[举报]
(2)用过量铜片与0.2 mol浓H2SO4共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1 mol,理由是____________________________________;
而乙同学认为产生的SO2为0.1 mol,理由是________________________________________。
(3)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为______________________________________。利用铜制备CuSO4的另一种方法可用化学方程式表示为___________________________。以上两种方法___________(填“前”“后”)者好,原因是_________________________。
查看习题详情和答案>>②用过量铜片0.2 mol与浓H2SO4共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1 mol,理由是________,而乙同学认为产生的SO2恰为0.1mol,理由是________。
查看习题详情和答案>>
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L.
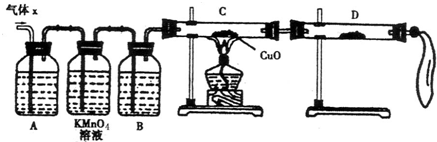
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究.
①A中加入的试剂可能是
②证实气体X中混有杂质气体,D中应选择的试剂是
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为:
(12分)某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。
(1) 化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列 。
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为: 。
查看习题详情和答案>>
(12分)某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列 。
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为: 。