摘要:已知A.B.C.D四种元素的电子层数均不超过3层.A元素原子的最外层电子数是次外层电子数的2倍,B元素原子最外层电子数是其内层电子总数的3倍,C元素原子次外层电子数等于其原子电子总数的一半,D元素原子最外层只有1个电子.D的阳离子与B的阴离子电子层结构相同.则4种元素的核电荷数的关系中能够成立的是( ) ①C>D>B>A ②D>B>A>C ③A>D>C>B ④B>A>C>D A.只有① B.只有③ C.①② D.②④ 解析:根据原子核外电子排布的规律.因A元素原子的最外层电子数是次外层电子数的2倍.所以A元素为碳元素,B元素原子最外层电子数是其内层电子总数的3倍.所以B元素为氧元素,C元素原子次外层电子数等于其原子核外电子总数的一半.所以C为Be或S,D元素原子最外层只有1个电子.D的阳离子与B的阴离子电子层结构相同.所以D为钠元素.因此核电荷数关系为C>D>B>A或D>B>A>C.故C项正确. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_76165[举报]
已知A、B、C、D四种物质具有以下物理性质:
(1)已知A与D不发生反应,且均不与水反应.
①欲从A、D的混合物中分离提纯D,需进行的操作是:
a:溶解;b:
②上述a、b、c操作过程中均需用到的一种玻璃仪器为
(2)从B的水溶液中分离出B的操作名称为
(3)从C与水的混合物中分离提纯C所需的玻璃仪器有
查看习题详情和答案>>
| A | B | C | D | |
| 分散到水中 | 得悬浊液 | 得无色溶液 | 液体分层,且下层为无色油状液体 | 得无色溶液 |
| 熔点(℃) | 1452 | -21.3 | -11.5 | 801 |
| 沸点(℃) | 1703 | 78.9 | 117 | 1210 |
①欲从A、D的混合物中分离提纯D,需进行的操作是:
a:溶解;b:
过滤
过滤
(填操作名称,下同);c:蒸发
蒸发
.②上述a、b、c操作过程中均需用到的一种玻璃仪器为
玻璃棒
玻璃棒
.(2)从B的水溶液中分离出B的操作名称为
蒸馏
蒸馏
.(3)从C与水的混合物中分离提纯C所需的玻璃仪器有
分液漏斗、烧杯
分液漏斗、烧杯
.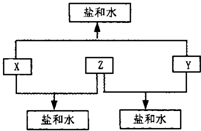 已知:已知A、B、C、D四种短周期元素原子序数依次增大,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
已知:已知A、B、C、D四种短周期元素原子序数依次增大,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.(1)D元素原子的结构示意图为


(2)A、B、C三种元素的原子半径由小到大的顺序为
N<Al<Na
N<Al<Na
(用元素符号表示);(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈
酸
酸
(填“酸”、“碱”或“中”)性;(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是
4HNO3
4NO2↑+2H2O+O2↑
| ||
4HNO3
4NO2↑+2H2O+O2↑
(用化学方程式表示).
| ||
(2011?沈阳二模)已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1:2.D元素的氢化物能刻蚀玻璃.
(1)A的分子式是
(2)B分子的中心原子的杂化类型是
(3)C的化学式是
(4)D元素氢化物的沸点比HCl的沸点高,其主要原因是
查看习题详情和答案>>
(1)A的分子式是
Ar
Ar
,写出A原子的价层电子排布式3s23p6
3s23p6
.(2)B分子的中心原子的杂化类型是
sp3
sp3
,分子空间构型是V型
V型
,该分子属于极性
极性
分子(填“极性”或“非极性”).(3)C的化学式是
N2H4
N2H4
,分子中含有的化学键类型是非极性键、极性键
非极性键、极性键
.(4)D元素氢化物的沸点比HCl的沸点高,其主要原因是
HF分子之间能形成氢键
HF分子之间能形成氢键
.已知A、B、C、D四种短周期元素原子序数依次增大,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,B、C、D三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且X、Y、Z可两两相互反应生成盐和水,请用相应的化学用语回答下列问题:
(1)D元素原子的结构示意图为
 ;
;
(2)X与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
(3)A、B、C三种元素的原子半径由小到大的顺序为
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈
查看习题详情和答案>>
(1)D元素原子的结构示意图为


(2)X与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(3)A、B、C三种元素的原子半径由小到大的顺序为
N<Al<Na
N<Al<Na
;(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈
酸
酸
(填“酸”、“碱”或“中”)性,该溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(Cl-)
c(OH-)<c(H+)<c(NH4+)<c(Cl-)
.