摘要:9.在l3+6 H l(浓)=l+3l2↑+3H2的反应中.氧化剂是 .还原产物是 .得电子与失电子个数比是 .氧化产物与还原产物的质量比是 .试标出反应电子转移方向和数目
网址:http://m.1010jiajiao.com/timu3_id_73216[举报]
 (2011?顺德区模拟)(1)在-50℃时,液氨存在如下电离:2NH3?NH4++NH-2,k=2×10-12,液氨的电离达到平衡时,各微粒的浓度大小关系为
(2011?顺德区模拟)(1)在-50℃时,液氨存在如下电离:2NH3?NH4++NH-2,k=2×10-12,液氨的电离达到平衡时,各微粒的浓度大小关系为c(NH3)>c(NH4+)=c(NH2-)
c(NH3)>c(NH4+)=c(NH2-)
,加入NH4Cl固体,K=
=
2×10-12(填“<”、“>”或“=”)(2)已知25℃时Ksp(AgCl)=1.8×10--10,在10mL 0.10mol/L AgNO3溶液中加入10mL0.20mol/LNaCl溶液,充分反应后溶液中的c(Ag+)=
3.6×10-9mol/L
3.6×10-9mol/L
.(3)配平硫酸亚铁加强热制备铁红和生成硫的两种常见氧化物的化学方程式:
2
2
FeSO4| 高温 |
1
1
Fe2O3+1
1
SO2↑
SO2↑
+1
1
SO3↑
SO3↑
(4)已知氯气能溶于水,溶液呈酸性.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
BC
BC
A.产生气体的体积:①>②
B.溶液的pH变化:①减小,②增大
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 2Cl--2e-?Cl2↑ ②中负极 2H++2e-?H2↑
如图所涉及的物质均为中学化学中的常见物质,其中其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
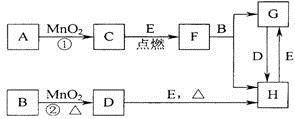
(1)写出有关物质的化学式:F
(2)写出B与MnO2共热获得D的化学方程式
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX)=1.8×10-10.将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10-4mol/L,则生成沉淀所需原AgNO3溶液的最小浓度为
查看习题详情和答案>>

(1)写出有关物质的化学式:F
Fe3O4
Fe3O4
,AH2O2
H2O2
.(2)写出B与MnO2共热获得D的化学方程式
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX)=1.8×10-10.将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10-4mol/L,则生成沉淀所需原AgNO3溶液的最小浓度为
3.6×10-6mol/L
3.6×10-6mol/L
.若向AgX悬浊液中滴加KI溶液,观察到的现象白色沉淀会转变成黄色沉淀
白色沉淀会转变成黄色沉淀
.下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中常见的金属单质,J是黄绿色气态单质,M与氨水反应生成的O是白色沉淀。在B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。

请按要求回答:
(1)H元素在周期表中的位置 。
(2)反应③的离子方程式 ;
反应④的化学方程式 。
(3)实验室用固体L配制溶液的方法是:
。
(4)由L的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是 。若要提纯该胶体,采用的方法叫 。
查看习题详情和答案>>