摘要:48.在3N2+H2 = 2HN3+N↑反应中.氧化剂与还原剂的分子数之比为 ( ) A.2∶1 B.1∶2 .3∶1 D.1∶3
网址:http://m.1010jiajiao.com/timu3_id_73206[举报]
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下:

回答下列问题:
(1)上述转化关系中属于氧化还原反应的是
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:
(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是
查看习题详情和答案>>

回答下列问题:
(1)上述转化关系中属于氧化还原反应的是
①④⑧
①④⑧
(填编号),其中需要使用氧化剂的是④⑧
④⑧
(填编号).(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
 Cr2O72-+H2O
Cr2O72-+H2O2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
. Cr2O72-+H2O
Cr2O72-+H2O(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:
Cr(OH)3+OH-=CrO2-+2H2O
Cr(OH)3+OH-=CrO2-+2H2O
.(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极
Fe-2e=Fe2+
Fe-2e=Fe2+
阴极2H++2e=H2↑
2H++2e=H2↑
溶液中6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
.(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是
AgCl
AgCl
. 某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑
(1)请在右边方框中画出能够实现这一反应的装置图
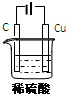

(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的
①实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色.
请你分析其原因
两极与电源的正负极接反了
两极与电源的正负极接反了
.②假设按照该方案进行实验,且收集到碳棒上产生气体体积为11.2L(标准状况下).则该过程中铜片上发生的反应式为
2H++2e-=H2↑
2H++2e-=H2↑
.③此时要使溶液恢复到实验前的状态,需加入
H2O
H2O
(写出该物质的化学式),其质量为18g
18g
.(2010?诸城市模拟)研究化学反应对人类社会的发展进步有重要意义.
(1)已知:N2(g)+3H2(g)2NH3(g)△H1=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H2=-523.6kJ/mol
H2O(g)=H2O(l)△H3=-44.0kJ/mol
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应生成氨气,试写出此反应的热化学方程式
(2)现有反应:Cu+H2SO4═CuSO4+H2,欲通过如图1所示装置实现上述反应,请选择合适的装置在括
号内标出电极材料(填“Cu”或“C”),并且写出C电极上的电极反应式
(3)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率.水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去.则CaSO4 转化为CaCO3的离子方程式为
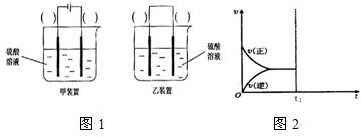
(4)科学研究发现纳米级Cu2O的可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:2H2O(g)
2H2(g)+O2(g)△H>0,不同时段产生O2的量见下表:
则:
①该条件下上述反应的化学平衡常数K=
②若达到平衡后在t1时刻保持温度不变,将容器的体积缩小,请在图2中画出正、逆反应速率随时间变化的关系图.
查看习题详情和答案>>

(1)已知:N2(g)+3H2(g)2NH3(g)△H1=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H2=-523.6kJ/mol
H2O(g)=H2O(l)△H3=-44.0kJ/mol
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应生成氨气,试写出此反应的热化学方程式
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=-1650kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=-1650kJ/mol
.(2)现有反应:Cu+H2SO4═CuSO4+H2,欲通过如图1所示装置实现上述反应,请选择合适的装置在括
号内标出电极材料(填“Cu”或“C”),并且写出C电极上的电极反应式
2H++2e-→H2↑
2H++2e-→H2↑
.(3)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率.水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去.则CaSO4 转化为CaCO3的离子方程式为
CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
.(4)科学研究发现纳米级Cu2O的可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:2H2O(g)
| 光 |
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
①该条件下上述反应的化学平衡常数K=
1.7×10-6mol/L
1.7×10-6mol/L
;②若达到平衡后在t1时刻保持温度不变,将容器的体积缩小,请在图2中画出正、逆反应速率随时间变化的关系图.
 按要求对下图中两极进行必要的连接并填空:
按要求对下图中两极进行必要的连接并填空:(1)在A图中,使铜片上冒H2气泡.请加以必要连接,则连接后的装置叫
原电池
原电池
.电极反应式:锌极:Zn-2e-=Zn2+
Zn-2e-=Zn2+
;铜极:2H++2e-=H2↑
2H++2e-=H2↑
.(2)在B图中(a,b都为惰性电极),使a极析出铜,则b析出:
氧气
氧气
.加以必要的连接后,该装置叫电解池
电解池
.电极反应式,a极:Cu+2e-=Cu 2+
Cu+2e-=Cu 2+
b极发生氧化反应
氧化反应
反应(氧化或还原).经过一段时间后,停止反应并搅均溶液,溶液的[H+]升高
升高
(升高、降低、不变),加入一定量的CuO
CuO
,溶液能恢复至与电解前完全一致. (2010?汕头一模)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下
(2010?汕头一模)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下回答下列问题:
(1)上述反应中需用氧化剂的是
④、⑧
④、⑧
(填编号).(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式:阳 极
Fe-2e-═Fe2+
Fe-2e-═Fe2+
阴 极2H++2e═H2↑
2H++2e═H2↑
溶液中
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式
2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
 Cr2O72-+H2O
Cr2O72-+H2O2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
. Cr2O72-+H2O
Cr2O72-+H2O(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是
AgCl
AgCl
.(5)要将Fe3+溶液中的杂质离子Cr3+除去,可加入过量NaOH溶液,过滤后再用酸溶解.写出有关的离子方程式
Cr3++4OH-═CrO2-+2H2O;Fe3++3OH-═Fe(OH)3↓、Fe(OH)3+3H+═Fe3++3H2O
Cr3++4OH-═CrO2-+2H2O;Fe3++3OH-═Fe(OH)3↓、Fe(OH)3+3H+═Fe3++3H2O
.