摘要:17.2SO2(g)+O2(g)催化剂Δ2SO3(g)反应过程的能量变化如下图所示.已知1 mol SO2(g)氧化为1mol SO3(g)的ΔH=-99kJ·mol-1. 请回答下列问题: (1)图中A.C分别表示 . .E的大小对该反应的反应热有无影响? .该反应通常用V2O5作催化剂.加V2O5会使图中B点升高还是降低? .理由是 , (2)图中ΔH= kJ·mol-1, (3)V2O5的催化循环机理可能为:V2O5氧化SO2时.自身被还原为四价钒化合物,四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式 , (4)如果反应速度v(SO2)为0.05 mol·L-1·min-1.则v(O2)= mol·L-1·min-1.v(SO3)= mol·L-1·min-1, (5)已知单质硫的燃烧热为296kJ·mol-1.计算由S(s)生成3 mol SO3(g)的ΔH. 解析:(1)反应热只与反应的始态和终态有关.催化剂能降低活化能使E值减小,(2)图示为2 mol SO2反应的情况,(3)四价钒化合物为VO2,(4)依计量数之比可推出,(5)依盖期定律推出. 答案:(1)反应物能理 生成物能量 没有影响 降低 催化剂能降低活化能使E值减小 (2)-198 (3)SO2+V2O5===SO3+2VO2.4VO2+O2===2V2O5 (4)0.025 0.05 +O2(g)===SO2(g),ΔH1=-296kJ·mol-1. SO2(g)+O2(g)===SO3(g),ΔH=-99kJ·mol-1. 3S(s)+O2(g)===3SO3(g),ΔH=(ΔH1+ΔH2)×3=-1185kJ·mol-1
网址:http://m.1010jiajiao.com/timu3_id_72740[举报]
以含硫铁矿石为原料生产硫酸的工艺流程图如下:

请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4
2Fe2O3+8SO2.
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)
A.
B.
C.
D.
(2)接触室中发生反应的化学方程式是
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少
,则SO2的转化率为
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是
已知每240g SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是
(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
查看习题详情和答案>>

请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4
FeS2
FeS2
+11O2
| ||
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)
D
D
.A.
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
(2)接触室中发生反应的化学方程式是
2SO2+O2
3SO3
| 催化剂 |
| △ |
2SO2+O2
3SO3
.| 催化剂 |
| △ |
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少
| 1 |
| 5 |
80%
80%
.(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
abd
abd
.a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是
浓硫酸
浓硫酸
(写名称).已知每240g SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是
SO3(g)+H2O(l)═H2SO4(l);△H=-130.3kJ/mol
SO3(g)+H2O(l)═H2SO4(l);△H=-130.3kJ/mol
.(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
SO2+Br2+2H2O═4H++2Br-+SO42-
SO2+Br2+2H2O═4H++2Br-+SO42-
.(1)SiO2的
(2)明矾化学式
(3)溴单质,溴离子,碘单质,碘离子同时加到同一烧杯中的离子方程式
(4)课本上出现的可逆反应一个是二氧化硫溶于水,还有两个工业应用广泛的方程式为
查看习题详情和答案>>
网状
网状
结构决定了它有优良的物理化学性质.(2)明矾化学式
KAl(SO4)2?12H2O
KAl(SO4)2?12H2O
(3)溴单质,溴离子,碘单质,碘离子同时加到同一烧杯中的离子方程式
Br2+2I-=2Br-+I2
Br2+2I-=2Br-+I2
(4)课本上出现的可逆反应一个是二氧化硫溶于水,还有两个工业应用广泛的方程式为
N2+3H2
2NH3,2SO2+O2
2SO3
| ||
| 高温高压 |
| ||
| △ |
N2+3H2
2NH3,2SO2+O2
2SO3
.
| ||
| 高温高压 |
| ||
| △ |
下列图示与对应的叙述相符的是( )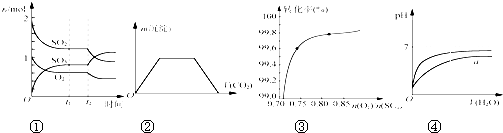

A、图①表示一定条件下进行的反应2SO2+O2
| |||
| B、图②表示向Ba(OH)2、KAlO2混合溶液中通入CO2 | |||
C、如图③在其他条件不变时,2SO2(g)+O2(g)
| |||
| D、图④表示pH相同的盐酸与醋酸中分别加入水后pH的变化,其中曲线a对应的是盐酸 |
 a、b、c、d、e是含有一种相同元素的五种物质,可发生如图转化:其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如图转化:其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物.(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示):
a
硫
硫
;b硫化氢
硫化氢
;c二氧化硫
二氧化硫
;d三氧化硫
三氧化硫
;e硫酸
硫酸
.并写出由c生成d的化学方程式
2SO2+O2
2SO3
| 催化剂 |
| △ |
2SO2+O2
2SO3
| 催化剂 |
| △ |
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a
N2
N2
;bNH3
NH3
;cNO
NO
;dNO2
NO2
;eHNO3
HNO3
.并写出由d生成e的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(2012?长春三模)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:
②该反应达到平衡状态的标志是
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变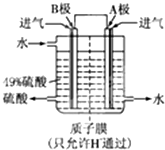
(2)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.
①B电极的电极反应式为
②溶液中H+的移动方向由
电池总反应式为
(3)利用烧渣制绿矾的过程如下:
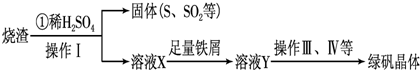
测定绿矾产品中含量的实验步骤:
a.称取5.7g产品,溶解,配成250mL溶液
b.量取25mL待测液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
+
②用硫酸酸化的KMnO4滴定终点的标志是
③计算上述产品中FeSO4?7H2O的质量分数为
查看习题详情和答案>>
(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2
| 催化剂 |
| △ |
①该反应的平衡常数表达式为:
K=
| c2(SO3) |
| c(O2)?c2(SO2) |
K=
.| c2(SO3) |
| c(O2)?c2(SO2) |
②该反应达到平衡状态的标志是
BD
BD
.A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变

(2)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.
①B电极的电极反应式为
SO2-2e-+2H2O═SO42-+4H+
SO2-2e-+2H2O═SO42-+4H+
;②溶液中H+的移动方向由
B
B
极到A
A
极;电池总反应式为
2SO2+O2+2H2O═2H2SO4
2SO2+O2+2H2O═2H2SO4
.(3)利用烧渣制绿矾的过程如下:

测定绿矾产品中含量的实验步骤:
a.称取5.7g产品,溶解,配成250mL溶液
b.量取25mL待测液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
5
5
Fe2++1
1
Mn| O | - 4 |
8
8
H+
H+
--5
5
Fe3++1
1
Mn2++4
4
H2O
H2O
②用硫酸酸化的KMnO4滴定终点的标志是
滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色
滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色
.③计算上述产品中FeSO4?7H2O的质量分数为
0.975或97.5%
0.975或97.5%
.