摘要:23.某强酸性溶液X.含有Ba2+.Al3+.SiO32-.NH4+.Fe2+.Fe3+. CO32-.SO42-.NO3-中的一种或几种离子.取溶液进行连续实验.能实现如下转化: 依据以上信息.回答下列问题: (1)上述离子中.溶液X中肯定含有的是: ,不能肯定的是: .对不能确定是否存在的离子.可以另取X溶液于一支试管中.选择下列试剂中的一种加入X溶液中.根据现象就可判断.则该试剂是: .(选填:①NaOH溶液.②酚酞试剂.③石蕊试剂.④pH试纸.⑤KSCN溶液.⑥KMnO4溶液) (2)气体F的化学式为: .沉淀G的化学式为: .沉淀K的化学式为: .实验中.可以观察到反应②的现象是: . (3)写出步骤①所有发生反应的离子方程式 . . (4)要使步骤③中.D.H2O.O2三种物质恰好发生化合反应.则D.H2O.O2物质的量之比是: . [解析]强酸性溶液中含有H+.则不含SiO32-.CO32-,加入Ba(NO3)2溶液后生成的沉淀一定是BaSO4.则溶液中含有SO42-.不含Ba2+,气体A能够和氧气反应.所以A为NO.D为NO2.D到E的反应为:4NO2+O2+2H2O4HNO3.说明该溶液中含有还原性离子.即Fe2+.则原溶液中一定没有NO3-.溶液B能够和NaOH溶液反应生成气体.则该气体一定是NH3.原溶液中一定含有NH4+.符合转化关系:“BH沉淀K 的K为Al(OH)3.则溶液中含有Al3+. [答案](1)SO42-.Al3+.Fe2+.NH4+ Fe3+ ⑤ (2)NH3 Fe(OH)3 Al(OH)3 气体由无色变成红棕色 (3)Ba2++SO42-=BaSO4↓ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O (4)4∶2∶1 () 来源: 版权所有:()
网址:http://m.1010jiajiao.com/timu3_id_71721[举报]
(2009?宜宾模拟)某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是:
①NaOH溶液 ②酚酞试剂 ③石蕊试剂 ④pH试纸 ⑤KSCN溶液 ⑥KMnO4溶液
(2)气体F的化学式为:
(3)写出步骤①所有发生反应的离子方程式
(4)要使步骤③中,D、H2O、O2三种物质恰好发生化合反应,则D、H2O、O2物质的量之比是:
查看习题详情和答案>>

依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是:
SO42-、Al3+、Fe2+、NH4+
SO42-、Al3+、Fe2+、NH4+
,不能肯定的是:Fe3+
Fe3+
.对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中根据现象就可判断,则该试剂是:⑤
⑤
①NaOH溶液 ②酚酞试剂 ③石蕊试剂 ④pH试纸 ⑤KSCN溶液 ⑥KMnO4溶液
(2)气体F的化学式为:
NH3
NH3
,沉淀G的化学式为:Fe(OH)3
Fe(OH)3
,沉淀K的化学式为:Al(OH)3
Al(OH)3
,实验中,可以观察到反应②的现象是:气体由无色变红棕色
气体由无色变红棕色
.(3)写出步骤①所有发生反应的离子方程式
Ba2++SO42-=BaSO4↓
Ba2++SO42-=BaSO4↓
、3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
.(4)要使步骤③中,D、H2O、O2三种物质恰好发生化合反应,则D、H2O、O2物质的量之比是:
4:2:1
4:2:1
.(2011?晋中模拟)某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
(2)沉淀G的化学式为
(3)写出有关离子方程式:
①中生成A:
②:
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子(Q)只有一种.当沉淀C物质的量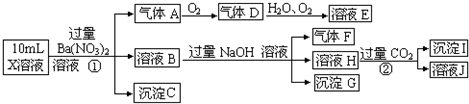
查看习题详情和答案>>
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
Al3+、NH4+、Fe2+、SO42-
Al3+、NH4+、Fe2+、SO42-
,不能确定是否含有的离子(Q)是Fe3+、Cl-
Fe3+、Cl-
,若要确定该Q(若不止一种,可任选一种)不存在,其最可靠的化学方法是:取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+;或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-
取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+;或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-
.(2)沉淀G的化学式为
Fe(OH)3
Fe(OH)3
.(3)写出有关离子方程式:
①中生成A:
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
.②:
CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
.(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子(Q)只有一种.当沉淀C物质的量
>0.07mol
>0.07mol
,表明Q离子一定是Fe3+
Fe3+
.
某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
(2)沉淀I的化学式为
 .
.
(3)写出生成A的离子方程式:
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含
查看习题详情和答案>>

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
A13+、NH4+、Fe2+、SO42-
A13+、NH4+、Fe2+、SO42-
,不能确定是否含有的离子(M)是Fe3+Cl-
Fe3+Cl-
,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是取少量X溶液于试管中,加入几滴KSCN溶液,溶液不变红色则说明无Fe3+;或取少量B溶液于试管中,加入几滴AgNO3溶液,若无白色沉淀说明无Cl-
取少量X溶液于试管中,加入几滴KSCN溶液,溶液不变红色则说明无Fe3+;或取少量B溶液于试管中,加入几滴AgNO3溶液,若无白色沉淀说明无Cl-
.(2)沉淀I的化学式为
Al(OH)3
Al(OH)3
,气体F的电子式为

(3)写出生成A的离子方程式:
3Fe2++4H++NO3-═3Fe3++NO+2H2O
3Fe2++4H++NO3-═3Fe3++NO+2H2O
.(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式
3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O
3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O
.(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为
C(NH4+)>C(NO3-)>C(OH-)>C(H+)
C(NH4+)>C(NO3-)>C(OH-)>C(H+)
.(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含
Fe3+
Fe3+
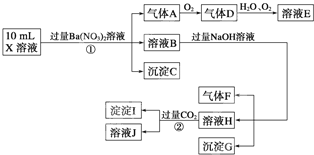
.某强酸性溶液X可能含有Ba2+、Al3+、N
、Fe2+、Fe3+、C
、S
、S
、Cl-、N
、N
中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
(2)沉淀I的化学式为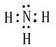
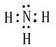 .
.
(3)写出反应②的离子方程式:
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式
(5)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有
查看习题详情和答案>>
| H | + 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 4 |
| O | - 2 |
| O | - 3 |

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
Al3+、NH4+、Fe2+、SO42-
Al3+、NH4+、Fe2+、SO42-
,不能确定是否含有的离子(M)是Fe3+、Cl-
Fe3+、Cl-
,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是取少量X溶液于试管中,加入几滴KSCN溶液不变红色则说明无Fe3+;或取少量B溶液少许于试管中,加几滴AgNO3溶液,若无白色沉淀说明无Cl-
取少量X溶液于试管中,加入几滴KSCN溶液不变红色则说明无Fe3+;或取少量B溶液少许于试管中,加几滴AgNO3溶液,若无白色沉淀说明无Cl-
.(2)沉淀I的化学式为
Al(OH)3
Al(OH)3
,气体F的电子式为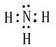
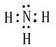
(3)写出反应②的离子方程式:
AlO2-+CO2+H2O=Al(OH)3↓+HCO3-
AlO2-+CO2+H2O=Al(OH)3↓+HCO3-
.(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式
3ClO-+2Fe(OH)3+4OH-=3Cl-+FeO42-+5H2O
3ClO-+2Fe(OH)3+4OH-=3Cl-+FeO42-+5H2O
.(5)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有
Fe3+
Fe3+
.(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: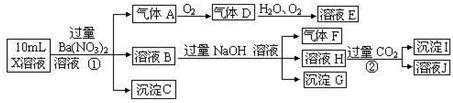
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ▲ ,不能确定是否含有的离子(M)是 ▲ ,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是 ▲ 。
▲ 。
(2)沉淀I的化学式为 ▲ ,气体F的电子式为 ▲ 。
(3)写出生成A的离子方程式: ▲ 。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。请写出制备过程中的离子方程式 ▲ 。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为 ▲ 。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含 ▲ 。