题目内容
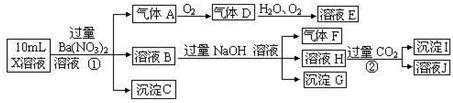
某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
(2)沉淀I的化学式为
 .
.
(3)写出生成A的离子方程式:
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
A13+、NH4+、Fe2+、SO42-
A13+、NH4+、Fe2+、SO42-
,不能确定是否含有的离子(M)是Fe3+Cl-
Fe3+Cl-
,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是取少量X溶液于试管中,加入几滴KSCN溶液,溶液不变红色则说明无Fe3+;或取少量B溶液于试管中,加入几滴AgNO3溶液,若无白色沉淀说明无Cl-
取少量X溶液于试管中,加入几滴KSCN溶液,溶液不变红色则说明无Fe3+;或取少量B溶液于试管中,加入几滴AgNO3溶液,若无白色沉淀说明无Cl-
.(2)沉淀I的化学式为
Al(OH)3
Al(OH)3
,气体F的电子式为

(3)写出生成A的离子方程式:
3Fe2++4H++NO3-═3Fe3++NO+2H2O
3Fe2++4H++NO3-═3Fe3++NO+2H2O
.(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式
3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O
3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O
.(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为
C(NH4+)>C(NO3-)>C(OH-)>C(H+)
C(NH4+)>C(NO3-)>C(OH-)>C(H+)
.(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含
Fe3+
Fe3+
.分析:强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有
SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答(1)(2)(3)题,根据氧化还原反应的知识解答第(4)题,根据溶液中离子浓度大小比较解答(5)题,据溶液电中性解答(6)题.
SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答(1)(2)(3)题,根据氧化还原反应的知识解答第(4)题,根据溶液中离子浓度大小比较解答(5)题,据溶液电中性解答(6)题.
解答:解:(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,检验方法是 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-; 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无
Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-(其它合理答案也对).
(2)铝离子在加入过量的NaOH溶液后,生成四羟基合铝酸钠溶液,该溶液能和二氧化碳反应生成I氢氧化铝和碳酸氢钠,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,铵根离子能和氢氧化钠在加热的条件下生成F:氨气,氨气的电子式为: ,故答案为:Al(OH)3;
,故答案为:Al(OH)3; ;
;
(3)Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成G:Fe(OH)3,和次氯酸反应获得高铁酸钾的方程式为:
3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,故答案为:3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O;
(5)根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O可知A是一氧化氮,D是二氧化氮,所以溶液E是硝酸,气体F是氨气,硝酸和氨气反应生成硝酸铵,在硝酸铵溶液中,铵根水解导致溶液显酸性,
离子浓度大小关系为:C(NH4+)>C(NO3-)>C(OH-)>C(H+),
故答案为:C(NH4+)>C(NO3-)>C(OH-)>C(H+);
(6)A、F、I均为0.1mol,50mLX溶液中n(H+)=0.4mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.3mol,根据溶液电中性可知:n(H+)+2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),
n(SO42-)=
=0.7mol,当沉淀C物质的量>0.7mol时一定含有Fe3+离子,反之,
含有Cl-离子,故答案为:Fe3+.
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-; 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无
Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-(其它合理答案也对).
(2)铝离子在加入过量的NaOH溶液后,生成四羟基合铝酸钠溶液,该溶液能和二氧化碳反应生成I氢氧化铝和碳酸氢钠,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,铵根离子能和氢氧化钠在加热的条件下生成F:氨气,氨气的电子式为:
 ,故答案为:Al(OH)3;
,故答案为:Al(OH)3; ;
;(3)Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成G:Fe(OH)3,和次氯酸反应获得高铁酸钾的方程式为:
3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,故答案为:3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O;
(5)根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O可知A是一氧化氮,D是二氧化氮,所以溶液E是硝酸,气体F是氨气,硝酸和氨气反应生成硝酸铵,在硝酸铵溶液中,铵根水解导致溶液显酸性,
离子浓度大小关系为:C(NH4+)>C(NO3-)>C(OH-)>C(H+),
故答案为:C(NH4+)>C(NO3-)>C(OH-)>C(H+);
(6)A、F、I均为0.1mol,50mLX溶液中n(H+)=0.4mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.3mol,根据溶液电中性可知:n(H+)+2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),
n(SO42-)=
| 0.4+2×0.3+3×0.1+0.1 |
| 2 |
含有Cl-离子,故答案为:Fe3+.
点评:本题考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性,本题易错点为(6)题,注意溶液电中性的利用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ▲ 。
▲ 。
