摘要:(09-10·福建长乐二中高二下期中) 如图所示.甲.乙两池的电极材料都是铁棒与碳棒.请回答下列问题: (1)把化学能转化为电能的装置是 . (2)①若两池中均盛有CuSO4溶液.反应一段时间后.有红色物质析出的是甲池中的 棒.乙池中的 棒. ②乙池中碳极上电极反应式是 . (3)若两池中均盛有饱和NaCl溶液. ①写出乙池中总反应的化学方程式为 . ②若将湿润的淀粉KI试纸放在乙池碳极附近.发现试纸变 .发生此现象的离子方程式为 , 若往乙池中滴入酚酞试液. 棒附近呈现红色. ③若乙池中通过0.02mol 电子后停止实验.反应后池中溶液体积是200mL.溶液混匀后的c(OH-)为 . 答案: 甲 . (2)① C . Fe . ②4OH--4e-=2H2O + O2↑ (3)① 2NaCl+2H2O 2NaOH+Cl2↑+H2↑ ② 蓝 . Cl2 + 2I- = 2Cl- + I2 铁 . ③ 0.1 mol•L-1 . 29(09-10·浙江宁波四中高二下期中) 右图两个装置中.溶液体积均为200mL.开始时.电解质溶液的浓度均为0.1mol/L.工作一段时间后.测得导线上都通过了0.02mol e一.若不考虑溶液体积的变化.则下列叙述正确的是 A.在①中Cu棒为阳极,在②中Cu棒为负极 B.电极上析出物质的质量:①<② C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑, ② ① ②中负极:2H+ + 2e一= H2↑ D.溶液的pH:①不变,②增大
网址:http://m.1010jiajiao.com/timu3_id_70990[举报]
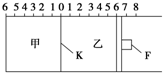 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题:
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题:(1)达到平衡后隔板K是否可能处于0刻度
不可能
不可能
(填“可能”或“不可能”).若K最终停留在0刻度左侧a处,则a一定小于2
2
.(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为
1
1
mol,乙中SO3的转化率>
>
50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度②
②
处(填下列序号:①<6 ②>6 ③=6).(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲
=
=
乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于1-w%
1-w%
.(4)平衡后将甲容器的混合气的1.0%通入足量Ba(NO3)2溶液,生成的BaSO4质量为
4.66
4.66
克. 如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显的胀大(忽略液体体积对气球的影响).则所用试剂可能分别依次是( )
如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显的胀大(忽略液体体积对气球的影响).则所用试剂可能分别依次是( )| A、甲:浓硫酸和木炭 乙:浓氨水和HBr | B、甲:双氧水和MnO2 乙:NaOH溶液和NO2 | C、甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | D、甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气 |
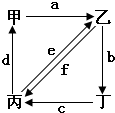 如图所示,甲、乙、丙、丁分别代表CO2、Na2CO3、NaOH、NaHCO3四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系.对于图中两种物质间的转化,通过一步反应就能实现的有 ( )
如图所示,甲、乙、丙、丁分别代表CO2、Na2CO3、NaOH、NaHCO3四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系.对于图中两种物质间的转化,通过一步反应就能实现的有 ( )
查看习题详情和答案>>
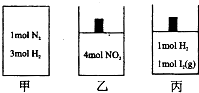 如图所示的甲、乙、丙三个绝热容器中分别发生的反应为:
如图所示的甲、乙、丙三个绝热容器中分别发生的反应为:甲:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
乙:2NO2(g)?N2O4
丙:H2(g)+I2(g)?2HI(g)
则下列有关说法不正确的是( )
| A、若甲的体积为2L,经过10秒后反应达到平衡状态,放出热量为55.44U,则H2的反应速率是0.09mol/(L?s) | B、若甲、乙中反应达到平衡时的体积相同,则两容器中所含物质的量可能相同 | C、若乙、丙中反应达到平衡时的体积、压强均相同,则乙中NO2的转化率为50% | D、若甲、乙、丙中反应均达到平衡状态时,则甲中物质的平均相对分子质量不变,乙中物质的颜色不变,丙中的温度不变 |
 (2009?黄浦区二模)如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂可能是( ) (2009?黄浦区二模)如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则滴管和烧瓶中所用试剂可能是( )
|
查看习题详情和答案>>