摘要:5.在0.10.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+对于该平衡.下列叙述正确的是 ( ) A.加入水时.平衡向逆反应方向移动 B.加入少量NaOH固体.平衡向正反应方向移动 C.加入少量0.1mol·L-1HCl溶液.溶液中c(H+)减小 D.加入少量CH3COONa固体.平衡向正反应方向移动
网址:http://m.1010jiajiao.com/timu3_id_70674[举报]
将3.9g Na2O2投入到足量的水中充分反应.回答:
(1)生成的气体在标准状况下的体积为
(2)该反应中所消耗的水的质量为
(3)将反应后的溶液配成1000mL溶液,所得溶液的物质的量浓度为
查看习题详情和答案>>
(1)生成的气体在标准状况下的体积为
0.56
0.56
L.(2)该反应中所消耗的水的质量为
0.9
0.9
g.(3)将反应后的溶液配成1000mL溶液,所得溶液的物质的量浓度为
0.1
0.1
mol?L-1.17克NH3共有
查看习题详情和答案>>
4
4
mol原子,0.1molH2S共有0.2NA
0.2NA
个氢原子;同质量的NH3和H2S中分子个数比为2:1
2:1
.在标准状况下,35.5g氯气的体积是11.2
11.2
L,将其与氢气完全化合,需氢气的物质的量是0.5
0.5
mol,将生成的气体配制成1L溶液,溶质的物质的量浓度是1
1
mol?L-1,将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是0.1
0.1
mol?L-1. 实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题
实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题(1)应用托盘天平称取十水合碳酸钠(Na2CO3?10H2O)晶体
14.3
14.3
g.(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,1g以下用游码,天平平衡时,则实际称量的十水合碳酸钠质量
B
B
(填符号 A、偏高 B、偏低 C、不变)(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为(同一步骤可用多次) B→A→
D
D
→F→C
C
→F→EA、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量 D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果
(4)配制Na2CO3溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、
500mL容量瓶
500mL容量瓶
、胶头滴管
胶头滴管
.(5)若实验遇下列情况,溶液的浓度是 A、偏高 B、偏低 C、不变(用符号回答)
A、加水定容时越过刻度线
B
B
B、忘记将洗涤液转入容量瓶
B
B
C、容量瓶内壁附有水珠而未干燥处理
C
C
D、溶解后没有冷却便进行定容
A
A
E、称量的碳酸钠晶体部分失水
A
A
(6)请你帮助把标签上的内容写一下(如右图).
Na2CO3溶液
Na2CO3溶液
,0.1
0.1
mol/L. 如图为为串联的甲、乙两电解池,试回答:
如图为为串联的甲、乙两电解池,试回答:(1)若甲池利用电解原理在铁上镀银,则A是
铁
铁
极,B的电极材料是银
银
,电极反应式为Ag-e-=Ag+
Ag-e-=Ag+
,应选用的电解质溶液是AgNO3溶液
AgNO3溶液
.(2)若甲电解池阴极增重4.32g,则乙电解池中阳极上放出的气体在标准状况下的体积是
448
448
mL.(3)若乙池中剩余溶液仍为400mL,则电解后产物的物质的量浓度为
0.1
0.1
mol?L-1,溶液的pH为13
13
.(1)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
酸式滴定管用蒸馏水洗净后,还应该进行的操作是
;若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会
(2)图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用
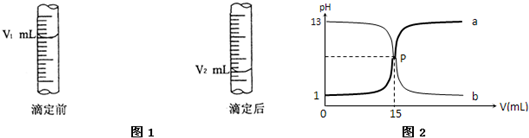
查看习题详情和答案>>
酸式滴定管用蒸馏水洗净后,还应该进行的操作是
用标准盐酸润洗2-3次
用标准盐酸润洗2-3次
;图1是酸式滴定管中液面在滴定前后的读数,则c (NaOH)=| a(V2-V1) |
| V |
| a(V2-V1) |
| V |
偏高
偏高
(偏高、偏低).(2)图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用
NaOH
NaOH
溶液滴定HCl
HCl
溶液;曲线b是用HCl
HCl
溶液滴定NaOH
NaOH
溶液;盐酸的物质的量浓度为0.1
0.1
mol/L.