题目内容
将3.9g Na2O2投入到足量的水中充分反应.回答:
(1)生成的气体在标准状况下的体积为
(2)该反应中所消耗的水的质量为
(3)将反应后的溶液配成1000mL溶液,所得溶液的物质的量浓度为
(1)生成的气体在标准状况下的体积为
0.56
0.56
L.(2)该反应中所消耗的水的质量为
0.9
0.9
g.(3)将反应后的溶液配成1000mL溶液,所得溶液的物质的量浓度为
0.1
0.1
mol?L-1.分析:n(Na2O2)=
=0.05mol,根据反应的方程式2Na2O2+2H2O=4NaOH+O2↑计算该题,
| 3.9g |
| 78g/mol |
解答:解:n(Na2O2)=
=0.05mol,
则 2Na2O2+2H2O=4NaOH+O2↑
2mol 36g 4mol 22.4L
0.05mol m(H2O) n(NaOH) V(O2)
(1)V(O2)=
=0.56L,
故答案为:0.56;
(2)m(H2O)=
=0.9g
故答案为:0.9;
(3)n(NaOH)=
=0.1mol,c(NaOH)=
=0.1mol/L,
故答案为:0.1.
| 3.9g |
| 78g/mol |
则 2Na2O2+2H2O=4NaOH+O2↑
2mol 36g 4mol 22.4L
0.05mol m(H2O) n(NaOH) V(O2)
(1)V(O2)=
| 0.05mol×22.4L |
| 2mol |
故答案为:0.56;
(2)m(H2O)=
| 0.05mol×36g |
| 2mol |
故答案为:0.9;
(3)n(NaOH)=
| 0.05mol×4mol |
| 2mol |
| 0.1mol |
| 1L |
故答案为:0.1.
点评:本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意根据反应的化学方程式解答该题,难度不大.

练习册系列答案
相关题目
将3.9g镁铝合金,投入到500mL 2mol/L的盐酸中,合金完全溶解,再加入5mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )
| A、100mL | B、150mL | C、200mL | D、250mL |



 Na2CO3+X,X的电子式是______.
Na2CO3+X,X的电子式是______.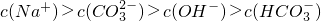
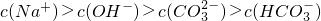
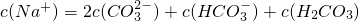

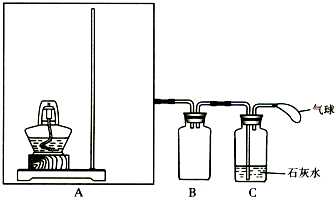
 (1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是 。
(1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是 。