摘要:2.分析下表.可总结出“在原子中.质子数等于电子数 .还能总结出: 原子种类 质子数 中子数 电子数 相对原子质量 氢 1 0 1 1 氧 8 8 8 16 钠 11 12 11 23 铁 26 30 26 56 ① ② ③
网址:http://m.1010jiajiao.com/timu3_id_7036[举报]
分析下表,可总结出“在原子中,质子数等于电子数”.还能总结出(至少两条):
①______;
②______;
③______.
查看习题详情和答案>>
| 原子种类 | 质子数 | 中子数 | 电子数 | 相对原子质量 |
| 氢 | 1 | 0 | 1 | 1 |
| 氧 | 8 | 8 | 8 | 16 |
| 钠 | 11 | 12 | 11 | 23 |
| 铁 | 26 | 30 | 26 | 56 |
②______;
③______.
下表列出了几种原子的构成及相对原子质量的大小,其中电子的质量约是中子或质子质量的
.通过观察分析,可以总结出一条规律:在原子中,质子数等于核外电子数.你一定还能总结出其他规律,请填写:
(1)
(2)
(3)
查看习题详情和答案>>
| 1 |
| 1836 |
| 原子种类 | 质子数 | 中子数 | 电子数 | 相对原子质量 |
| 氢 | 1 | 0 | 1 | 1 |
| 碳12 | 6 | 6 | 6 | 12 |
| 碳13 | 6 | 7 | 6 | 13 |
| 钠 | 11 | 12 | 11 | 23 |
| 镁 | 12 | 12 | 12 | 24 |
相对原子质量≈质子数+中子数
相对原子质量≈质子数+中子数
.(2)
原子核内不一定有中子
原子核内不一定有中子
.(3)
原子核内质子数不一定等于中子数
原子核内质子数不一定等于中子数
.下表是元素周期表的一部分

(1)原子序数为14的元素名称是
(2)图A是某元素的原子结构示意图,该元素在元素周期表中的位置是(填①或②或③)
(3)A元素的原子结构示意图为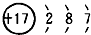 ,该元素在化学反应中容易
,该元素在化学反应中容易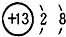 ,该离子带
,该离子带
(4)表中不同种元素最本质的区别是
A.相对原子质量不同 B.质子数不同 C.中子数不同
(5)对1-18号元素的原子结构示意图进行分析,可以发现许多规律,如在同一周期,从左到右,核外电子数依次递增.请再总结出其它规律,并写出其中一条:
查看习题详情和答案>>
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第二 周期 |
3 Li 锂 |
4 Be 铍 |
5 B 硼 |
① | 7 N 氮 |
8 O 氧 |
9 F 氟 |
10 Ne 氖 |
| 第三 周期 |
11 Na 钠 |
② | 13 Al 铝 |
14 Si 硅 |
③ | 16 S 硫 |
17 Cl 氯 |
18 Ar 氩 |

(1)原子序数为14的元素名称是
硅
硅
;原子序数为12的元素符号是Mg
Mg
(2)图A是某元素的原子结构示意图,该元素在元素周期表中的位置是(填①或②或③)
①
①
;(3)A元素的原子结构示意图为
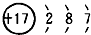 ,该元素在化学反应中容易
,该元素在化学反应中容易得到
得到
(填“得到”或“失去”)电子变成氯
氯
离子,属于非金属
非金属
元素(填“金属”或“非金属”);B元素的离子结构示意图为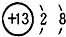 ,该离子带
,该离子带3
3
个单位正电荷,该元素的原子核外总共有13
13
个电子.(4)表中不同种元素最本质的区别是
B
B
(填序号):A.相对原子质量不同 B.质子数不同 C.中子数不同
(5)对1-18号元素的原子结构示意图进行分析,可以发现许多规律,如在同一周期,从左到右,核外电子数依次递增.请再总结出其它规律,并写出其中一条:
同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同,或最右纵行的原子结构均为稳定结构,或同一周期原子的最外层电子数从左到右逐渐增加
同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同,或最右纵行的原子结构均为稳定结构,或同一周期原子的最外层电子数从左到右逐渐增加
.下表列出了几种原子的构成及相对原子质量的大小,其中电子的质量约是中子或质子质量的
.通过观察分析,可以总结出一条规律:在原子中,质子数等于核外电子数.你一定还能总结出其他规律,请填写:
(1)______.
(2)______.
(3)______.
查看习题详情和答案>>
| 1 |
| 1836 |
| 原子种类 | 质子数 | 中子数 | 电子数 | 相对原子质量 |
| 氢 | 1 | 0 | 1 | 1 |
| 碳12 | 6 | 6 | 6 | 12 |
| 碳13 | 6 | 7 | 6 | 13 |
| 钠 | 11 | 12 | 11 | 23 |
| 镁 | 12 | 12 | 12 | 24 |
(2)______.
(3)______.
 小洁以“化学反应中,反应物与生成物的质量关系”为课题进行科学探究.请填写以下探究过程中的空格:
小洁以“化学反应中,反应物与生成物的质量关系”为课题进行科学探究.请填写以下探究过程中的空格: