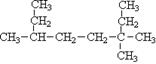摘要: (2) (3)阴极: (写成2H+ +2e- = H2 ↑也给分) 阳极: (4) 0.75 mol·L-1
网址:http://m.1010jiajiao.com/timu3_id_65099[举报]
某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜.活动过程如下:

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
装置图:
 ,正极反应
,正极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
①通入足量氯气,目的
②加入CuO调节溶液的PH至
③过滤除去
(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
(5)电解过程中的阴极材料是
(6)采用排液法收集氯气,该液体是
查看习题详情和答案>>

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
.(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
装置图:


2Fe3++2e-═2Fe2+
2Fe3++2e-═2Fe2+
,负极反应Cu-2e-═Cu2+
Cu-2e-═Cu2+
.(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
| 氢氧化物开始沉淀时的PH | 氢氧化物沉淀完全时的PH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
;②加入CuO调节溶液的PH至
3.2-4.7
3.2-4.7
;③过滤除去
Fe(OH)3
Fe(OH)3
(填化学式)(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 |
酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 |
溶液出现血红色,则绿色溶液C仍有Fe3+ 溶液出现血红色,则绿色溶液C仍有Fe3+ |
纯铜
纯铜
.(6)采用排液法收集氯气,该液体是
饱和食盐水
饱和食盐水
,原因Cl2在饱和食盐水中溶解度较小
Cl2在饱和食盐水中溶解度较小
.根据金属活动性顺序表,Cu不能发生:Cu+2H2O=Cu(OH)2+H↑的反应.但选择恰当电极材料和电解液进行电解,这个反应就能变为现实.下列四组电极和电解液中,能实现该反应最为恰当的是( )
|
查看习题详情和答案>>
用指定材料做阳极和阴极来电解一定浓度的溶液甲,然后加入物质乙能使溶液物质为甲溶液原来的浓度,则合适的组合是( )
|
| A、A | B、B | C、C | D、D |
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO) Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:

请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外, 还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
查看习题详情和答案>>