题目内容
某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜.活动过程如下:

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
装置图:
 ,正极反应
,正极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
①通入足量氯气,目的
②加入CuO调节溶液的PH至
③过滤除去
(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
(5)电解过程中的阴极材料是
(6)采用排液法收集氯气,该液体是

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
.(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
装置图:


2Fe3++2e-═2Fe2+
2Fe3++2e-═2Fe2+
,负极反应Cu-2e-═Cu2+
Cu-2e-═Cu2+
.(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
| 氢氧化物开始沉淀时的PH | 氢氧化物沉淀完全时的PH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
;②加入CuO调节溶液的PH至
3.2-4.7
3.2-4.7
;③过滤除去
Fe(OH)3
Fe(OH)3
(填化学式)(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 |
酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 |
溶液出现血红色,则绿色溶液C仍有Fe3+ 溶液出现血红色,则绿色溶液C仍有Fe3+ |
纯铜
纯铜
.(6)采用排液法收集氯气,该液体是
饱和食盐水
饱和食盐水
,原因Cl2在饱和食盐水中溶解度较小
Cl2在饱和食盐水中溶解度较小
.分析:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液;
(3)先将Fe2+转化成Fe3+;再根据图表条件分析溶液的pH值,三价铁离子沉淀完全后,进行过滤即可;
(4)在A的溶液中滴入酸性KMnO4溶液,根据KMnO4溶液颜色变化,说明是否含有亚铁离子;
在C溶液中加入KSCN溶液,根据溶液是否变为红色,判断是否含有铁离子;
(5)电解回收Cu,溶液中铜离子发生还原反应,在阴极析出,故Cu应作阴极;
(6)Cl2在饱和食盐水中溶解度较小,可以用排饱和食盐水法收集氯气.
(2)根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液;
(3)先将Fe2+转化成Fe3+;再根据图表条件分析溶液的pH值,三价铁离子沉淀完全后,进行过滤即可;
(4)在A的溶液中滴入酸性KMnO4溶液,根据KMnO4溶液颜色变化,说明是否含有亚铁离子;
在C溶液中加入KSCN溶液,根据溶液是否变为红色,判断是否含有铁离子;
(5)电解回收Cu,溶液中铜离子发生还原反应,在阴极析出,故Cu应作阴极;
(6)Cl2在饱和食盐水中溶解度较小,可以用排饱和食盐水法收集氯气.
解答:解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成Fe2+,反应方程式为2Fe3++Cu═2Fe2++Cu2+,故答案为:2Fe3++Cu═2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为2Fe3++2e-═2Fe2+,铜失电子发生氧化反应,所以负极上的电极反应式为Cu-2e-═Cu2+;
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,
,
故答案为: ;2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+;
;2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+;
(3)根据图表知,Fe3+沉淀需要的PH值较小,与铜离子沉淀时的PH值相差较大,所以首先将二价铁离子转化为三价铁离子,选取的试剂不能引进新的杂质离子,所以选取氯气 作氧化剂;然后加热氧化铜除去氯气溶解生成的盐酸,在pH值3.2时三价铁离子完全沉淀,pH值4.7时铜离子开始沉淀,所以调节溶液的pH值至3.2-4.7;然后通过过滤除去生成的沉淀;
故答案为:①将Fe2+氧化成Fe3+;②3.2-4.7;③Fe(OH)3;
(4)在A的溶液中滴入酸性KMnO4溶液,KMnO4溶液颜色褪去,说明含有亚铁离子,否则,不含亚铁离子;
在C在溶液中加入KSCN溶液,溶液变为红色,说明含有铁离子,否则,不含铁离子,
故答案为:
;
(5)电解回收Cu,溶液中铜离子发生还原反应,在阴极析出,故纯Cu应作阴极,
故答案为:纯铜;
(6)Cl2在饱和食盐水中溶解度较小,可以用排饱和食盐水收集氯气,
故答案为:饱和食盐水;Cl2在饱和食盐水中溶解度较小.
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为2Fe3++2e-═2Fe2+,铜失电子发生氧化反应,所以负极上的电极反应式为Cu-2e-═Cu2+;
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为
 ,
,故答案为:
 ;2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+;
;2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+;(3)根据图表知,Fe3+沉淀需要的PH值较小,与铜离子沉淀时的PH值相差较大,所以首先将二价铁离子转化为三价铁离子,选取的试剂不能引进新的杂质离子,所以选取氯气 作氧化剂;然后加热氧化铜除去氯气溶解生成的盐酸,在pH值3.2时三价铁离子完全沉淀,pH值4.7时铜离子开始沉淀,所以调节溶液的pH值至3.2-4.7;然后通过过滤除去生成的沉淀;
故答案为:①将Fe2+氧化成Fe3+;②3.2-4.7;③Fe(OH)3;
(4)在A的溶液中滴入酸性KMnO4溶液,KMnO4溶液颜色褪去,说明含有亚铁离子,否则,不含亚铁离子;
在C在溶液中加入KSCN溶液,溶液变为红色,说明含有铁离子,否则,不含铁离子,
故答案为:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 | 溶液出现血红色,则绿色溶液C仍有Fe3+ |
(5)电解回收Cu,溶液中铜离子发生还原反应,在阴极析出,故纯Cu应作阴极,
故答案为:纯铜;
(6)Cl2在饱和食盐水中溶解度较小,可以用排饱和食盐水收集氯气,
故答案为:饱和食盐水;Cl2在饱和食盐水中溶解度较小.
点评:本题考查了化学工艺流程图、原电池的工作原理及原电池的设计、对操作的条件控制与理解,难度较大,原电池的设计是学习的重点和难度.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜.活动过程如下:
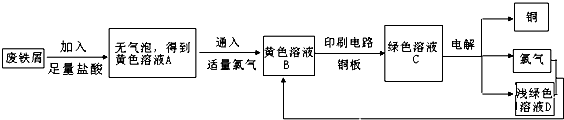
(1)写出废铁屑与盐酸反应的离子方程式: ; .
(2)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
(3)电解时阴极材料是 .
(4)采用排液法收集氯气,该液体是 .

(1)写出废铁屑与盐酸反应的离子方程式:
(2)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | ||
| ② | 检验绿色溶液C中是否含有Fe3+ |
(4)采用排液法收集氯气,该液体是

