摘要: 在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2.当它们混合时.即产生大量的氮气和水蒸气.并放出大量的热.已知0.4mol液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64kJ的热量 (1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应: N2H4+H3O+=N2H5++H2O N2H4+H2O N2H5++ N2H5++H2O N2H62++ N2H5++H2O N2H4+H3O+ 据此可得出的结论是 . A.肼水解显酸性 B.肼在水中可电离出H+离子 C.肼是二元弱碱 D.肼是二元弱酸 (2)写出肼和H2O2反应的热化学方程式 . (3)已知H2O(1)=H2O(g) △H=+44kJ/mol.则16g液态肼与足量双氧水反应生成氮气和液态水时.放出的热量是 . (4)上述反应应用于火箭推进器.除释放出大量热量和快速产生大量气体外.还有一个很突出的优点是 . (5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼.写出反应的化学方程式 .该反应的还原产物是 .
网址:http://m.1010jiajiao.com/timu3_id_57473[举报]
在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知0. 4mol液态肼和足量H2O2反应生成氮气和水蒸气时放出256. 65kJ的热量。
(1)写出肼和H2O2反应的热化学方程式_________________。
(2)已知H2O(l)==H2O(g) △H= +44kJ/mol,则16g液态肼与足量H2O2反应生成氮气和液态水时,放出的热量是________________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)== NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)==N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________________。
查看习题详情和答案>>
(1)写出肼和H2O2反应的热化学方程式_________________。
(2)已知H2O(l)==H2O(g) △H= +44kJ/mol,则16g液态肼与足量H2O2反应生成氮气和液态水时,放出的热量是________________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)== NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)==N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________________。
在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量.
(1)该反应用于火箭推进剂,除释放大量热量和快速产生大量气体外,还有很突出的优点是
(2)写出肼和双氧水反应的热化学方程式
(3)已知H2O(l)=H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是
查看习题详情和答案>>
(1)该反应用于火箭推进剂,除释放大量热量和快速产生大量气体外,还有很突出的优点是
产物为氮气和水,无污染
产物为氮气和水,无污染
.(2)写出肼和双氧水反应的热化学方程式
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol
.(3)已知H2O(l)=H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是
408.8KJ
408.8KJ
.在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4mol液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64kJ的热量。
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+=N2H5++H2O
N2H4+H2O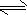 N2H5++OH-
N2H5++OH-
N2H5++H2O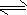 N2H62++OH-
N2H62++OH-
N2H5++H2O N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________。
A.肼水解显酸性
B.肼在水中可电离出H+离子
C.肼是二元弱碱
D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式_______________________。
(3)已知H2O(1)==H2O(g) △H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是___________________________。
(4)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是
_____________________。
(5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼,写出反应的化学方程式__________________________,该反应的还原产物是___________________。
查看习题详情和答案>>
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+=N2H5++H2O
N2H4+H2O
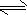 N2H5++OH-
N2H5++OH-N2H5++H2O
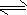 N2H62++OH-
N2H62++OH- N2H5++H2O
 N2H4+H3O+
N2H4+H3O+ 据此可得出的结论是______________。
A.肼水解显酸性
B.肼在水中可电离出H+离子
C.肼是二元弱碱
D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式_______________________。
(3)已知H2O(1)==H2O(g) △H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是___________________________。
(4)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是
_____________________。
(5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼,写出反应的化学方程式__________________________,该反应的还原产物是___________________。
在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和过氧化氢的结构式 肼______ ___,过氧化氢______ ____。
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是_____________________ _________。
(3)写出肼和双氧水反应的热化学方程式_____________________________。
(4)已知H2O(l)==H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是_________________。
(5)已知N2(g) + 2O2(g) == 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) == N2(g)+2H2O(g);△H= ―534KJ/mol,
则肼与NO2完全反应的热化学方程式为_______________________________。
查看习题详情和答案>>
在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热.已知0.4mol液态肼和足量H2O2(l)反应生成氮气和水蒸气时放出256.64kJ的热量
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+═N2H5++H2O N2H4+H2O?N2H5++
N2H5++H2O?N2H62++OH- N2H5++H2O?N2H4+H3O+
据此可得出的结论是______.
A.肼水解显酸性 B.肼在水中可电离出H+离子 C.肼是二元弱碱 D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式______.
(3)已知H2O(1)=H2O(g)△H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是______kJ.
(4)上述反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,还有一个很突出的优点是______.
(5)用氨和次氯酸钠按物质的量之比2:1混合可生成肼,写出反应的化学方程式______,该反应的还原产物是______.
查看习题详情和答案>>
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+═N2H5++H2O N2H4+H2O?N2H5++
N2H5++H2O?N2H62++OH- N2H5++H2O?N2H4+H3O+
据此可得出的结论是______.
A.肼水解显酸性 B.肼在水中可电离出H+离子 C.肼是二元弱碱 D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式______.
(3)已知H2O(1)=H2O(g)△H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是______kJ.
(4)上述反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,还有一个很突出的优点是______.
(5)用氨和次氯酸钠按物质的量之比2:1混合可生成肼,写出反应的化学方程式______,该反应的还原产物是______.
查看习题详情和答案>>