网址:http://m.1010jiajiao.com/timu3_id_56047[举报]
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
(2)步骤2、步骤3的实验目的都是
(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:
(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
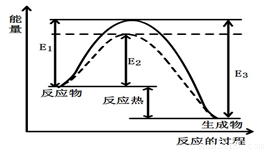
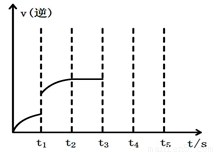
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式
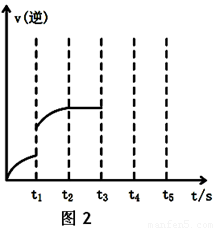
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
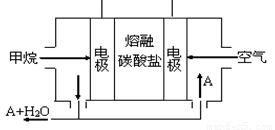
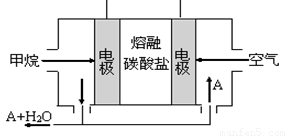
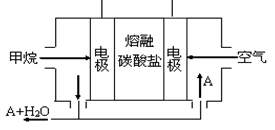
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
查看习题详情和答案>>
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
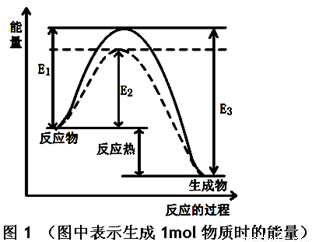
(1)根据图1请写出合成甲醇的热化学方程式
(热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号,下同)。
A. 2v(H2)(逆) =v(CO)(正)
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见右图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
查看习题详情和答案>>
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH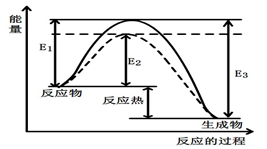
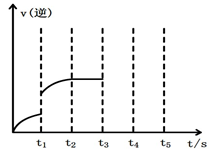
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
| A.2v(H2)(逆) =v(CO)(正) | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
 查看习题详情和答案>>
查看习题详情和答案>>
Ⅰ.某化学兴趣小组探究饱和氯水与石灰石的反应,并制取较浓的HClO溶液和对所得溶液中的部分阴离子进行检验.
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
(2)步骤2、步骤3的实验目的都是______,为达到该实验目的,还可以采取的方法是______.
(3)请你设计-个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:______.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组按以下步骤制取摩尔盐:
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离;
②用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与[(NH4)2SO4溶液混合,结晶得到摩尔盐.
试回答下列问题:
(1)如何从溶液中分解出摩尔盐?
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
(3)为了确定产品中亚铁离子的含量,某研究小组用KMnO4酸性溶液进行滴定,请写出该反应的离子方程式:______.
(4)现有等浓度的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液,其中c(NH4+)由大到小的顺序是:______(填序号). 查看习题详情和答案>>