摘要:18.答案:酸.碱或蛋白酶.α-氨基酸.氨基.羧基.α-氨基乙酸.H2N-CH2-COOH.盐析,变性,重金属盐. 解析:本题注意对蛋白质性质的记忆.
网址:http://m.1010jiajiao.com/timu3_id_55553[举报]
漂白粉是常用的消毒剂和漂白剂.根据所学知识,回答下列问题:
(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为
(2)漂白粉的有效成分是(填化学式)
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为
(4)将漂白粉溶于水中,呈白色浊状物,静置沉降.取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈
查看习题详情和答案>>
(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为
2Cl2+2Ca(OH)2═CaCl2+2H2O+Ca(ClO)2
2Cl2+2Ca(OH)2═CaCl2+2H2O+Ca(ClO)2
.(2)漂白粉的有效成分是(填化学式)
Ca(ClO)2
Ca(ClO)2
.(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为
Ca(ClO)2+H2O+CO2═CaCO3 ↓+2HClO
Ca(ClO)2+H2O+CO2═CaCO3 ↓+2HClO
.(4)将漂白粉溶于水中,呈白色浊状物,静置沉降.取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈
碱
碱
性(填“酸、碱或中”),并具有漂白
漂白
性.常温下,两种溶液:①0.1mol/L HAC ②0.1mol/L NaAC.
(1)溶液①的pH
(2)溶液②呈
(3)两种溶液中c(AC-)的大小为
a.两种溶液中c(AC-)都等于0.1mol/L
b.两种溶液中c(AC-)都小于0.1mol/L
c.HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①
查看习题详情和答案>>
(1)溶液①的pH
<
<
7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是c(H+)=c(AC-)+c(OH-)
c(H+)=c(AC-)+c(OH-)
.(2)溶液②呈
碱
碱
性(填“酸”、“碱”或“中”).其原因是AC-+H2O?HAC+OH-,AC-水解显碱性
AC-+H2O?HAC+OH-,AC-水解显碱性
(用离子方程式表示).(3)两种溶液中c(AC-)的大小为
bc
bc
(填序号).a.两种溶液中c(AC-)都等于0.1mol/L
b.两种溶液中c(AC-)都小于0.1mol/L
c.HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①
<
<
②(填“=”或“>”或“<”)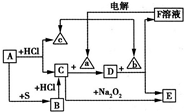 中学化学中几种常见物质的转化关系如下所示(部分反应的生成物已略去),其中A、a、c是单质,a为黄绿色气体,E为红褐色沉淀.请回答下列问题:
中学化学中几种常见物质的转化关系如下所示(部分反应的生成物已略去),其中A、a、c是单质,a为黄绿色气体,E为红褐色沉淀.请回答下列问题:(1)写出下列物质的化学式:B
FeS
FeS
,bNaOH
NaOH
.(2)D的水溶液呈 (填“酸”、“碱”或“中”)性,将饱和的D溶液加入沸水中并继续煮沸一段时间后得到的液体(填序号).
①是溶液
②是胶体
③具有丁达尔现象
④可全部透过滤纸
(3)写出下列反应的离子方程式:
①电解F的水溶液:
2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
;
| ||
②C与等物质的量的Na2O2在溶液中反应:
4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+
.A、B、C、D、E五种元素,它们满足以下条件.
①分别属于不同主族,且均为短周期元素;
②A、B的氢化物的沸点均比它们相邻周期、同族元素的氢化物的沸点高,且A元素的氢化物常温下为液态;
③原子半径大小顺序是A<B<C<D<E;
④C的最外层电子数等于B、D的最外层电子数之和.
(1)A元素是
(2)这五种元素的单质中,沸点最高的是
(3)A、B的氢化物分子结合H+能力较强的是
(4)C、D形成的化合物的水溶液呈
查看习题详情和答案>>
①分别属于不同主族,且均为短周期元素;
②A、B的氢化物的沸点均比它们相邻周期、同族元素的氢化物的沸点高,且A元素的氢化物常温下为液态;
③原子半径大小顺序是A<B<C<D<E;
④C的最外层电子数等于B、D的最外层电子数之和.
(1)A元素是
氧
氧
,C元素是氯
氯
,E元素是钠
钠
(填元素名称).(2)这五种元素的单质中,沸点最高的是
Mg
Mg
(填元素符号).(3)A、B的氢化物分子结合H+能力较强的是
NH3
NH3
(填化学式),用一个离子方程式加以证明:NH3+H3O+=NH4++H2O
NH3+H3O+=NH4++H2O
.(4)C、D形成的化合物的水溶液呈
酸
酸
(填“酸”、“碱”或“中”性),其原因是Mg2++2H2O?Mg(OH)2+2H+
Mg2++2H2O?Mg(OH)2+2H+
(用离子方程式表示). (2013?河东区一模)短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:
(2013?河东区一模)短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:(1)Y在元素周期表中的位置是
第三周期第IIIA族
第三周期第IIIA族
;X氢化物的电子式是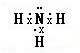
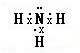
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈
酸性
酸性
(填“酸”、“碱”或“中性”),用离子方程式表示其原因是NH4++H2O?NH3.H2O+H+
NH4++H2O?NH3.H2O+H+
.(3)Y-AgO电池是应用广泛的鱼类电池,其原理如图所示.该电池的负极反应式是
Al+4OH--3e-=AlO2-+2H2O
Al+4OH--3e-=AlO2-+2H2O
.(4)Z和W比较.非金属性较弱的是
Si
Si
(填元素符号),下列可以验证这一结论的是bcd
bcd
(填序号).a、元素在地壳中的含量
b、最高价氧化物对应水化物的酸性
c、断开氢化物中1molH-Z或H-W键所需的能量
d、Z与W以共价键形成化合物时,Z或W显示的电性
(5)含W的物质通常有漂白、杀菌作用.其中可作水消毒剂的有
ClO2、NaClO
ClO2、NaClO
(写出其中两种物质的化学式).(6)由Z和W组成的化合物遇水立即水解产生两种酸,写出此反应的化学方程式
SiCl4+3H2O=H2SiO3+4HCl或 SiCl4+4H2O=H4SiO4+4HCl
SiCl4+3H2O=H2SiO3+4HCl或 SiCl4+4H2O=H4SiO4+4HCl
.