摘要:9.有四种短周期元素Y.M.Z.X.其原子序数依次增大.其微粒结构或性质特点如下表: 元素编号 元素微粒结构或性质特点 x 标准状况下X2的密度为3.17 g/L Y 原子最外层电子数为次外层电子数的2倍 Z 最高价氧化物E是通讯材料光导纤维的主要原料 M 0.l mol/L M的最高价氧化物的水化物N的水溶液pH=13 (1)M离子的离子结构示意图为: , (2)Y形成一种可用作装饰品的单质.其晶体的熔点与Z单质比较.熔点较高的是 .Z最高价氧化物晶体类型是 . (3)写出N与X2单质反应的离子方程式: (4)以石墨和铁作电极.用电解槽电解化合物MX的水溶液.阳极产生X2.铁应 作 极.若该电极逸出1.12 L气体.则电路中转移电子 mol.
网址:http://m.1010jiajiao.com/timu3_id_54646[举报]
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
请回答:
(1)X2Z的电子式是
 ;M2Z中所含化学键类型是
;M2Z中所含化学键类型是
(2)Y的非金属性比N
(3)YX4的结构式为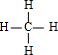
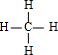 ;分子里各原子的空间分布具有
;分子里各原子的空间分布具有
(4)Y与X可形成原子个数为1:1的有机物,写出该有机物与氢气反应的方程式
查看习题详情和答案>>
| 元素 | 有关信息 |
| X | 在自然界中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要化合价为-2价 |
| M | 其单质及其化合物的焰色为黄色 |
| N | 与Y同主族,其单质为半导体材料 |
(1)X2Z的电子式是


离子键
离子键
.(2)Y的非金属性比N
强
强
(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-
CO2+H2O+SiO32-=H2SiO3↓+CO32-
(用离子方程式表示).(3)YX4的结构式为
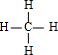
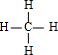
正四面体
正四面体
结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物有5
5
种.(4)Y与X可形成原子个数为1:1的有机物,写出该有机物与氢气反应的方程式
CH≡CH+H2
CH3CH3或 +3H2
+3H2
| 一定条件 |
 +3H2
+3H2| Ni |
| △ |

CH≡CH+H2
CH3CH3或 +3H2
+3H2

.| 一定条件 |
 +3H2
+3H2| Ni |
| △ |

四种短周期元素的性质或结构信息如下表,下列结论中错误的是( )
|
查看习题详情和答案>>
 四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是( )| A、原子半径Z<M | B、Y的最高价氧化物对应水化物的酸性比X的弱 | C、非金属性:X<Z | D、M元素最高价氧化物对应水化物具有两性 |
四种短周期元素的性质或结构信息如下表。下列推断错误的是
|
元素编号 |
元素性质或结构 |
|
T |
M层上有2对成对电子 |
|
X |
元素最高正价是+7价 |
|
Y |
第三周期元素的简单离子中半径最小 |
|
Z |
单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
A.T的氢化物是同族元素氢化物中沸点最低的
B.X的最高价氧化物对应的水化物,是无机含氧酸中的最强酸
C.离子半径从小到大的顺序:Y<Z< T < X
D.X、Y形成化合物的晶体类型与X、Z形成化合物的晶体类型不同
查看习题详情和答案>>
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( ) 
| | Y | Z | |
| M | X | | |
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2 周期、第ⅥA族 查看习题详情和答案>>