题目内容
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
请回答:
(1)X2Z的电子式是
 ;M2Z中所含化学键类型是
;M2Z中所含化学键类型是
(2)Y的非金属性比N
(3)YX4的结构式为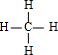
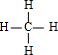 ;分子里各原子的空间分布具有
;分子里各原子的空间分布具有
(4)Y与X可形成原子个数为1:1的有机物,写出该有机物与氢气反应的方程式
| 元素 | 有关信息 |
| X | 在自然界中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要化合价为-2价 |
| M | 其单质及其化合物的焰色为黄色 |
| N | 与Y同主族,其单质为半导体材料 |
(1)X2Z的电子式是


离子键
离子键
.(2)Y的非金属性比N
强
强
(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-
CO2+H2O+SiO32-=H2SiO3↓+CO32-
(用离子方程式表示).(3)YX4的结构式为
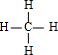
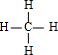
正四面体
正四面体
结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物有5
5
种.(4)Y与X可形成原子个数为1:1的有机物,写出该有机物与氢气反应的方程式
CH≡CH+H2
CH3CH3或 +3H2
+3H2
| 一定条件 |
 +3H2
+3H2| Ni |
| △ |

CH≡CH+H2
CH3CH3或 +3H2
+3H2

.| 一定条件 |
 +3H2
+3H2| Ni |
| △ |

分析:短周期元素X、Y、Z、M、N原子序数依次增大,X在自然界中原子半径最小,则X为氢元素;Y最外层电子数是次外层的2倍,则Y原子有2个电子层,最外层电子数为4,故Y为碳元素;M其单质及其化合物的焰色为黄色,则M为Na元素;Z元素的主要化合价为-2价,处于ⅥA族,原子序数小于钠元素,则Z为氧元素;N与Y同主族,其单质为半导体材料,则N为Si元素,据此解答.
解答:解:短周期元素X、Y、Z、M、N原子序数依次增大,X在自然界中原子半径最小,则X为氢元素;Y最外层电子数是次外层的2倍,则Y原子有2个电子层,最外层电子数为4,故Y为碳元素;M其单质及其化合物的焰色为黄色,则M为Na元素;Z元素的主要化合价为-2价,处于ⅥA族,原子序数小于钠元素,则Z为氧元素;N与Y同主族,其单质为半导体材料,则N为Si元素,
(1)H2O分子中氧原子与氢原子之间形成1对共用电子对,电子式为 ;Na2O中含有离子键,
;Na2O中含有离子键,
故答案为: ;离子键;
;离子键;
(2)同主族自上而下非金属性减弱,故非金属性C>Si,反应CO2+H2O+SiO32-=H2SiO3↓+CO32-,表明碳酸的酸性比硅酸强,可以说明C的非金属性强,
故答案为:强;CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)CH4的结构式为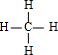 ;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
故答案为: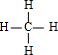 ;正四面体;5;
;正四面体;5;
(4)C与H可形成原子个数为1:1的有机物,该有机物为乙炔或苯,乙炔与氢气发生完全加成反应反应生成乙烷,反应方程式CH≡CH+H2
CH3CH3,苯与氢气发生加成反应生成环己烷,反应方程式为 +3H2
+3H2
 ,
,
故答案为:CH≡CH+H2
CH3CH3或 +3H2
+3H2
 .
.
(1)H2O分子中氧原子与氢原子之间形成1对共用电子对,电子式为
 ;Na2O中含有离子键,
;Na2O中含有离子键,故答案为:
 ;离子键;
;离子键;(2)同主族自上而下非金属性减弱,故非金属性C>Si,反应CO2+H2O+SiO32-=H2SiO3↓+CO32-,表明碳酸的酸性比硅酸强,可以说明C的非金属性强,
故答案为:强;CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)CH4的结构式为
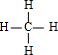 ;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,故答案为:
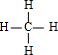 ;正四面体;5;
;正四面体;5;(4)C与H可形成原子个数为1:1的有机物,该有机物为乙炔或苯,乙炔与氢气发生完全加成反应反应生成乙烷,反应方程式CH≡CH+H2
| 一定条件 |
 +3H2
+3H2| Ni |
| △ |
 ,
,故答案为:CH≡CH+H2
| 一定条件 |
 +3H2
+3H2| Ni |
| △ |
 .
.点评:本题考查结构性质位置的关系、常用化学用语、物质推断、有机物的性质等,难度不大,推断元素是解题的关键.

练习册系列答案
相关题目
碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )
| 元素 | 熔点(℃) | 沸点(℃) | 与水作用 | 纯液体的导电性 |
| X | -183 | -162 | 不与水反应也不溶于水 | 不导电 |
| Y | -102 | 19 | 放热,形成的酸是弱酸 | 不导电 |
| Z | 680 | - | 剧烈反应生成H2,溶液呈碱性 | 导电 |
| A、X、Y、Z |
| B、Z、X、Y |
| C、Y、X、Z |
| D、Z、Y、X |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )